La lettre
n°44
ossier
heure, soit 50 % de l’effet maximal observé.
Les études récentes montrent que l’horloge
circadienne est en réalité particulièrement
sensible aux intensités lumineuses faibles,
et que l’exposition a un écran d’ordinateur à
LED (entre 40 et 100 lux) pendant 2h inhibe
partiellement la secrétions de mélatonine,
active la vigilance, retarde l’horloge biolo-
gique, et retarde l’endormissement.
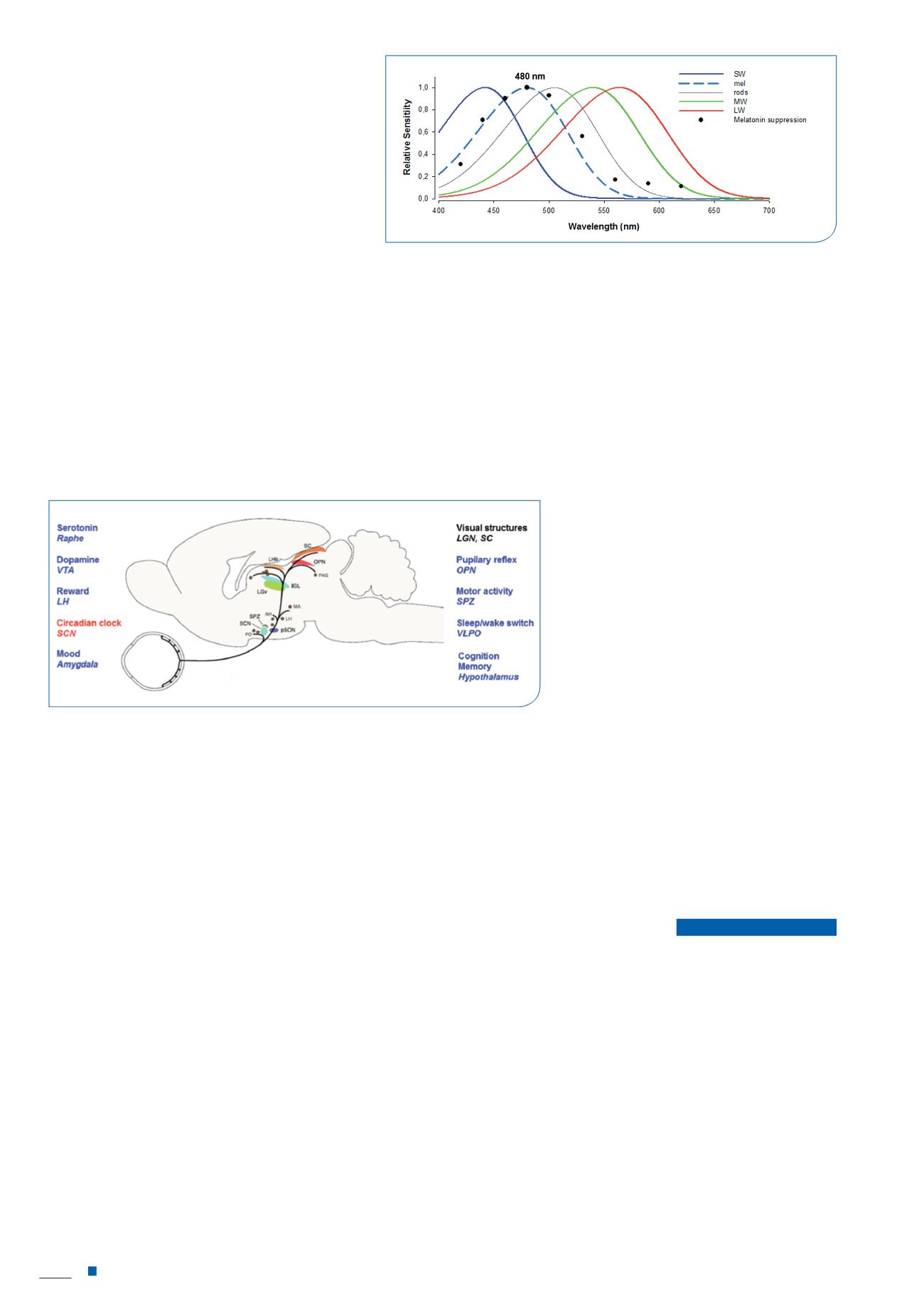
L’effet de la lumière
dépend de son spectre
.
Comme l’illustre la
figure 3
, le système circa-
dien est maximalement sensible à une lumière de couleur
comprise entre 460-480 nm (15). Une lumière monochro-
matique bleue (longueur d’onde de 480 nm) peut être aussi
efficace sur le système circadien qu’une lumière fluorescente
blanche 100 fois plus intense (comportant 100 fois plus de
photons). Cette propriété repose sur la sensibilité des cellules
ganglionnaires à mélanopsine.
Enfin, l’
effet de la lumière dépend de l’heure à laquelle elle
est perçue
. La courbe de réponse de phase montre que la
lumière à laquelle nous sommes exposés le soir et en début
de nuit (en moyenne entre 17 h et 5 h du matin) a pour effet
de retarder l’horloge, alors que la lumière reçue en fin de nuit
et le matin (en moyenne entre 5 h du matin et 17 h) a l’effet
inverse d’avancer l’horloge. C’est cette sensibilité temporelle
spécifique qui explique la synchronisation quotidienne de
l’horloge dans des conditions normales, et sa non-synchro-
nisation dans le jet-lag et le travail de nuit.
Lumière et fonctions non visuelles
Depuis la découverte des cellules ganglionnaires à mé-
lanopsine dans la rétine il y a 10 ans, plusieurs fonctions
non-visuelles, sensibles à la lumière, ont été décrites. Ces
fonctions impliquent des voies anatomiques et des struc-
tures cérébrales différentes de celles impliquées dans la
vision, et ne conduisent pas à la formation d’image (
Figure 4
).
Les études chez l’animal montrent des projections des
cellules ganglionnaires à mélanopsine vers des structures
impliquées dans la régulation des rythmes biologiques, la
régulation des états de veille et de sommeil, la régulation de
l’activité locomotrice, le réflexe pupillaire, etc. Chez l’Homme,
les études montrent que les cellules ganglionnaires à méla-
nopsine,
via
les voies non-visuelles, sont impliquées dans
l’effet de la lumière sur le décalage de phase de la méla-
tonine, l’augmentation de la vigilance, de la température et
de la fréquence cardiaque, l’expression du gène PER2, le
décalage de phase du rythme du gène PER3,
l’augmentation des performances psychomo-
trices et de l’activité EEG, la structure du som-
meil et l’activation de structures cérébrales
impliquées dans la mémoire et la régulation
de l’humeur. La lumière,
via
des projections
rétiniennes non visuelles, stimule directement
ou indirectement des structures cérébrales
impliquées dans le contrôle de la vigilance,
du sommeil, de l’humeur et des performances
cognitives et psychomotrices.
Conclusions
Compte tenu de l’importance de la synchro-
nisation du système circadien et de la nature
des fonctions non visuelles, la lumière apparaît
comme un besoin biologique indispensable au
bon fonctionnement de l’organisme. En outre, il
apparaît vraisemblable que la lumière sera utilisée dans le
futur dans le traitement de nombreuses conditions normales
ou pathologiques, dans lesquelles un dysfonctionnement
physiologique pourra être corrigé
via
l’activation de fonctions
non-visuelles de l’œil.
R
éférences
(1) Gronfier, C. Arch. Mal. Prof. Environ. 70, 253-261 (2009).
(2) Taillard, J. & Gronfier, in Sleep Disorders (Les troubles du Sommeil),
Da (eds), Elsevier, 2012. (ed. Elsevier) 25-43 (2012).
(3) Dunlap, J.C., et al., P.J. Chronobiology: Biological Timekeeping,
(Sinauer, 2004).
(4) Reppert, S.M. & Weaver, D.R. Nature 418, 935-941 (2002).
(5) Granda, T.G., et al., Faseb J 19, 304-306 (2005).
(6) Dunlap, Loros & DeCoursey (eds.). Chronobiology, Biological
Timekeeping, 405 (Sinauer Associates, Inc. Publishers, Sunderland,
Massachussetts, USA, 2004).
(7) Brandenberger, et al., The Lancet 356, 1408-1408 (2000).
(8) Vezoli, J., et al., PLoS ONE 6, e23952 (2011).
(9) Surveillance médico-professionnelle des travailleurs postés et/ou de
nuit. Recommandation de Bonne Pratique (Label HAS). (2012).
(10) Leger, D., et al., The Lancet 348, 830 (1996).
(11) Duffy, J.F., et al., Proc Natl Acad Sci U S A 108 Suppl 3, 15602-15608 (2011).
(12) Roenneberg, T., et al., Curr Biol 14, R1038-1039 (2004).
(13) Arendt, J. & Rajaratnam, Br J Psychiatry 193, 267-269 (2008).
(14) Mure, L.S., et al., PLoS One 4, e5991 (2009).
(15) Brainard, G.C., et al., J Neurosci 21(16), 6405 (2001).
Figure 3 :
sensibilité spectrale des photorécepteurs classiques (cônes SW, MW,
LW et bâtonnets: rods) et de la mélanopsine (mel) chez l’Homme. La sensibilité
du système circadien chez l’homme (estimée par la suppression de la mélatonine
– points noirs) est optimale à ~480 nm, correspondant au pic de sensibilité de la
mélanopsine. Les cônes et les bâtonnets sont impliqués dans la photoréception
circadienne mais leur contribution relative n’est pas connue [figure modifiée de
Taillard & Gronfier et al. 2012 (2)].
Figure 4 :
les cellules ganglionnaires à mélanopsine de la rétine projettent vers un
ensemble de structures impliquées dans la régulation du système circadien (SCN), du
réflexe pupillaire (PTA), de l’activité motrice (vSPZ, IGL), du sommeil (VLPO) et de la
vigilance (LC). Ces voies de projection constituent les voies non-visuelles de la lumière
(non visual ou non-image forming en englais) [figure modifiée de Taillard & Gronfier et
al. 2012 (2)]


