23
Ce procédé ne nécessite que quelques heures pour des
petits échantillons et jusqu’à un jour pour un cerveau de
souris ou de rat adulte. Il est compatible avec les divers
fluorochromes (CFP, GFP, YFP, RFP, mCherry, etc..), des mar-
queurs synthétiques et également avec des marquages
immunohistochimiques.
Pour un cerveau de souris adulte, le procédé consiste
à fixer et post-fixer le tissu avec du paraformaldéhyde
4 %, puis de le placer consécutivement dans des bains de
tetra-hydrofurane (THF)/H2O 50 % vol/vol, 80 % vol/vol et
100 % (THF). Une étape de délipidation est réalisée avec
un bain de dichlorométhane (DCM). L’échantillon est ensuite
rendu transparent dans une solution de dibenzyl ether (DBE).
À la fin de cette étape, les échantillons sont transparents car
du même indice de réfraction que le solvant DBE (=1,562).
Il existe cependant des limitations techniques et pratiques au
3DISCO. Essentiellement, parce que les étapes de « trans-
parisation » altèrent la composition chimique des tissus,
dissolvent les structures des lipides. Les tissus soumis à cette
technique ne peuvent être ensuite analysés en microscopie
électronique. Par ailleurs, les échantillons ne peuvent pas
être conservés pour une longue période, car les étapes de
déshydratation et délipidation dégradent le signal fluores-
cent GFP dans le temps. De ce fait, les échantillons GFP
doivent être imagés le plus rapidement possible après la
« transparisation ».
Cette technique est applicable à une grande variété de tis-
sus non pigmentés incluant la moelle épinière, le cerveau,
organes immuns et les tumeurs.
Précisons que des immunomarquages peuvent être éga-
lement réalisés sur ces tissus avant de les rendre transpa-
rents. Pour cela, des protocoles de marquages immunohis-
tochimiques de plusieurs jours à plusieurs semaines sont
nécessaires.
La méthode « CLARITY »
Mis au point sous la houlette de Karl Deisseroth (psychiatre
et spécialiste en bio-ingénierie, un des pionniers de l’opto-
génétique), ce nouveau type d’imagerie va probablement
révolutionner nos connaissances sur le fonctionnement du
cerveau. Cette technique, baptisée « Clarity »
(4)
par ses
inventeurs de l’université américaine de Stanford, a aussi
fonctionné sur un cerveau humain conservé depuis plus
de six ans. Ce procédé s’inscrit parfaitement dans le cadre
du projet BRAIN lancé par le gouvernement américain pour
établir une carte complète du cerveau humain.
Cette équipe de chercheurs nous livre un moyen pour enlever
les lipides responsables de l’opacité du cerveau de manière
non destructrice, pour faire pénétrer de la lumière et des
macromolécules profondément dans le tissus, ce qui permet
de faire des acquisitions conduisant à l’analyse moléculaire
en 3D d’un cerveau entier et intact (Figure 2). Le protocole
paraît simple: incuber le cerveau dans une solution d’hydro-
gel puis le chauffer à 37°C pendant trois heures. À ce stade,
le cerveau et l’hydrogel forment une « structure hybride »
qui maintient les lipides en place. Il n’y a plus alors qu’à
extraire les graisses en y faisant passer un courant électrique
(« l’électrophorèse »).
Utilisée seule ou avec d’autres méthodes histologiques
(immunohistochimie, hybridation
in situ
…), « Clarity » per-
met de réaliser des études complexes sur des échantillons
transparents (Figure 3). En effet, le tissu « hybride » traité
avec « Clarity » conserve ses biomolécules endogènes al-
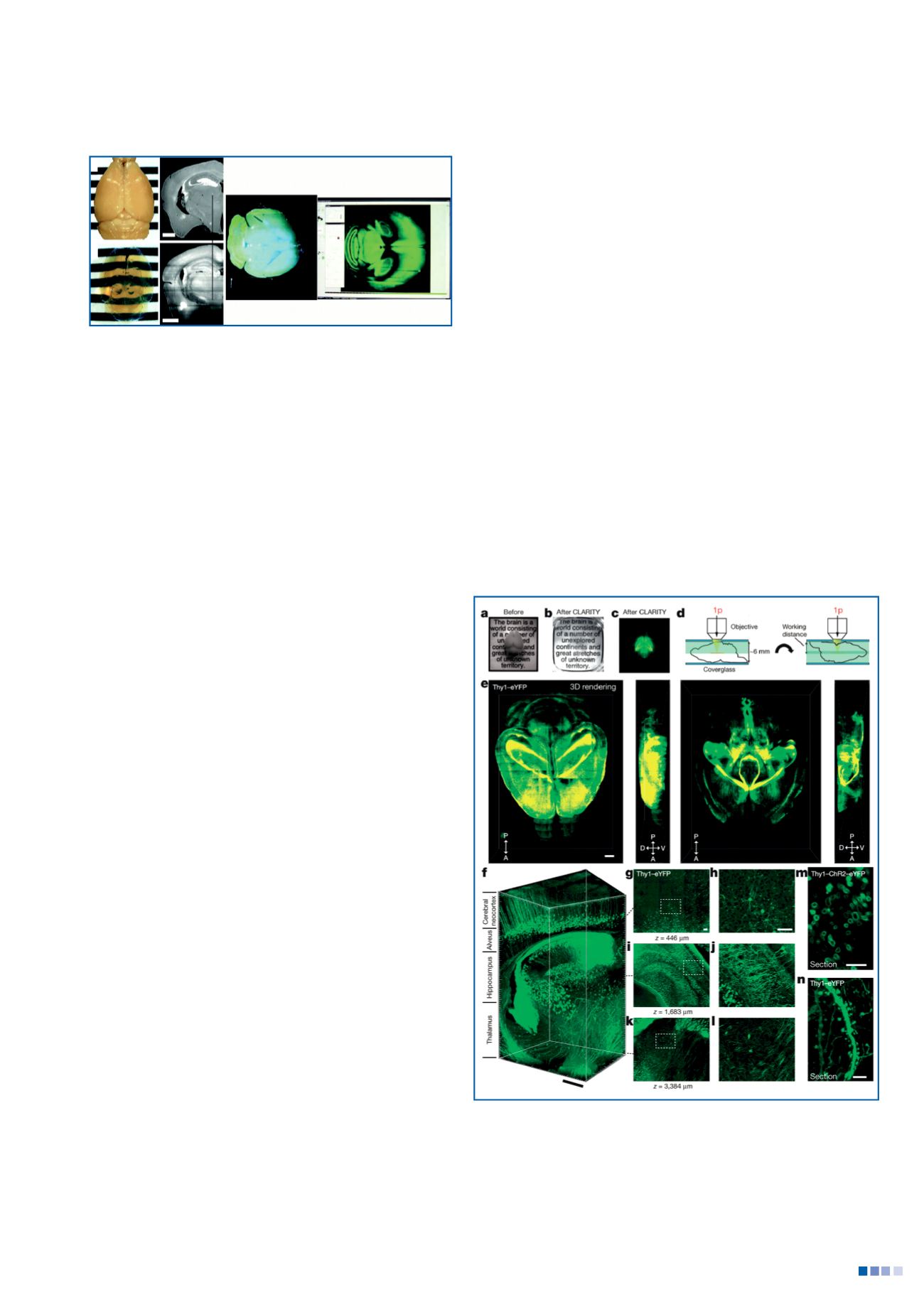
Figure 2 - Cerveau de souris Thy1-eGFP adulte « avant » et « après »
avoir été rendu transparent par la méthode « Clarity ». L’objectif du
microscope confocal directement placé sur le cerveau transparent
permet de réaliser des coupes optiques et une reconstruction
macroscopique et microscopique en 3D des neurones exprimant la GFP
Thy1-eYFP-H adulte. (Avec la permission de Macmillan Publishers Ltd:
Nature. Chung et al, 497(7449):332-337, copyright 2013).
Figure 1 - Cerveau de souris adulte exprimant la GFP « avant »
et « après » avoir été rendu transparent par la méthode 3DISCO.
Le cerveau transparent est ensuite placé dans la chambre
d’acquisition de l’ultramicroscope, sous l’objectif où des coupes
optiques du tissu sont réalisées. Avec la permission de Macmillan
Publishers Ltd: [nature protocols] (Ertürk et al), copyright
(2013).


