EBC Brain Mission – Understand, Fix and Enhance

Le 23 avril 2018, le Conseil européen du cerveau lance sa mission « cerveau ».
La mission peut paraître simple : Comprendre. Réparer. Améliorer. Mais, comme le cerveau est l’organe humain le plus complexe, les troubles cérébraux sont extrêmement compliqués à analyser, diagnostiquer et traiter par rapport à d’autres maladies. Un engagement continu et un soutien de la communauté scientifique et clinique à tous les niveaux est nécessaire. La population européenne bénéficiera des découvertes et des avancées en neurosciences qui devraient se traduire en nouveaux outils diagnostiques et traitements des troubles cérébraux.
On estime que 179 millions de citoyens européens vivent avec une maladie du cerveau. Ce chiffre couplé au coût annuel estimé de ces maladies (798 milliards d’euros) met en évidence l’immensité du problème. Aborder ces coûts majeurs pour la société européenne nécessite un effort de recherche intensifié et la création de solutions novatrices.
L’objectif de la mission « cerveau » sera de réduire cet énorme fardeau grâce à une meilleure compréhension de la physiologie du cerveau et des états pathologiques, des stratégies de prévention pertinentes, ainsi que plus généralement, une sensibilisation accrue au cerveau et à ses maladies.
En 2018, la Commission européenne devrait soumettre des propositions pour un 9ème programme-cadre orienté vers les missions et l’impact. En vue des préparatifs du prochain programme de recherche de l’UE, la mission « Cerveau » du Conseil Européen du Cerveau (EBC), soutenue par le Conseil Français du Cerveau (FBC) vise à attirer l’attention sur ces questions et à montrer comment le programme-cadre post-2020 peut faire une réelle différence pour les patients atteints de troubles cérébraux.
Le 20e siècle était le siècle de la Lune et de l’espace extra-atmosphérique ; le 21e siècle sera le siècle du cerveau.
Voir le texte du European Brain Council
TLR9 et GR dans la microglie : une nouvelle signalisation inflammatoire dans la maladie de Parkinson !
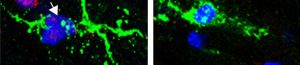
L’inflammation dans le cerveau est orchestrée par les cellules gliales dont font partie les cellules microgliales, macrophages du cerveau. Leur activation est présente dès les premiers stades de la maladie de Parkinson, maladie caractérisée par une perte massive des neurones dopaminergiques de la substance noire. De nombreuses études ont indiqué que les neurones dopaminergiques étaient particulièrement sensibles aux facteurs proinflammatoires. L’activation précoce et continue des microglies pourrait donc participer au processus de mort neuronale. En condition normale, la réponse inflammatoire induite par l’activation de récepteurs à la surface des cellules microgliales est finement régulée pour éviter tout dommage cellulaire. Les glucocorticoïdes (cortisol chez L’homme), via son récepteur (GR) est un acteur central de cette régulation en contrôlant l’expression des gènes inflammatoires. Or, des niveaux élevés de cortisol sont observables chez patients atteints de la maladie de Parkinson, suggérant une dérégulation de ce système et donc une potentielle implication dans cette pathologie. Dans une étude antérieure, l’équipe de Sheela Vyas avait montré l’impact délétère de l’invalidation du GR microglial sur la survie des neurones dopaminergiques dans un modèle murin de la maladie de Parkinson. Une augmentation du niveau d’expression d’un récepteur de l’immunité microglial, le TLR9, avait été notamment observée dans ce modèle murin mais également dans le cerveau de patients parkinsoniens.
Suite à ces observations, l’équipe de Sheela Vyas s’est alors questionnée sur le rôle du récepteur TLR9 dans la maladie de Parkison et si celui-ci était sous le contrôle du GR. Dans cette nouvelle étude, les auteurs révèlent la présence de la forme active du récepteur TLR9 chez les patients parkinsoniens et d’une réduction du nombre de microglies exprimant le GR, démontrant une dérégulation du GR dans ces cellules. En utilisant des souris dans lesquelles le GR est supprimé dans la microglie, des souris invalidées pour le TLR9 et des manipulations pharmacologiques, ils montrent que le GR régule étroitement l’activation du TLR9 dans la microglie. L’activation spécifique du TLR9 induit une perte des neurones dopaminergiques uniquement chez les souris n’ayant pas de GR microglial. Le GR prévient donc la signalisation inflammatoire induite par l’activation du TLR9 et protège de la perte des neurones dopaminergiques dans la substance noire dans des modèles de la maladie de Parkinson. Cette publication fournit des preuves d’une nouvelle voie contribuant à la neurodégénérescence dopaminergique impliquant la perte de la fonction du GR microgliale, créant un environnement permissif pour l’activation du TLR9 qui peut déclencher la mort neuronale dopaminergique.
Publication
Maatouk L, Compagnion AC, Sauvage MC, Bemelmans AP, Leclere-Turbant S, Cirotteau V, Tohme M, Beke A, Trichet M, Bazin V, Trawick BN, Ransohoff RM, Tronche F, Manoury B, Vyas S. TLR9 activation via microglial glucocorticoid receptors contributes to degeneration of midbrain dopamine neurons. Nat Commun. 2018 Jun 22;9(1):2450. doi: 10.1038/s41467-018-04569-y.
Contact chercheuse
Sheela Vyas
Laboratory of Gene Regulation and Adaptive Behaviors
Department of Neuroscience Paris Seine
CNRS UMR 8246/ INSERM U1130/ UPMC
Case Courrier 02
Université Pierre et Marie Curie
Bâtiment B, 2ème étage
9, Quai Saint Bernard
75252 Paris CEDEX 05, France
sheela.vyas@upmc.fr
Encodage temporel dans le réseau amygdalo-striatal
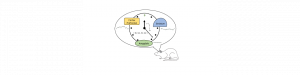
Comment le temps est-il représenté dans notre cerveau ? Pour aborder cette question, nous utilisons une tâche de conditionnement aversif chez le rat, dans laquelle un son prédit l’arrivée d’un stimulus négatif à un moment précis (par exemple, 30s après le début du son). Nous enregistrons l’activité oscillatoire de populations de neurones, via les potentiels de champ locaux, au sein d’un réseau de trois structures interconnectées : l’amygdale basolatérale (cruciale pour l’aspect émotionnel), le striatum dorsal et le cortex préfrontal (suspectés avoir un rôle dans l’estimation temporelle). La connectivité fonctionnelle/communication entre ces structures, observée au travers d’une augmentation de la cohérence de leurs oscillations respectives entre 3-6Hz, est modulée de telle sorte qu’elle encode la durée de l’attente du stimulus aversif. Cet encodage de la durée existe après seulement quelques essais d’apprentissage, alors même que l’apprentissage de l’association n’est pas complet. Ces résultats révèlent des corrélats neuronaux de l’encodage temporel, crucial pour la mémoire associative.
Auteurs : Lucille Tallot & Valérie Doyère
Neuro-PSI, CNRS UMR 9197, Cognition & Emotion, Université Paris Sud, Orsay
Lucille Tallot et Valérie Doyère ont présenté leurs travaux lors du FENS Forum of Neuroscience à Berlin.
Voir le communiqué de presse
Un nouveau mécanisme immunitaire mis en évidence dans la maladie d’Alzheimer
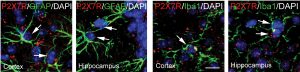
Une étude conduite par Cécile Delarasse et ses collaborateurs à l’ICM montre le rôle délétère du récepteur P2X7 et l’effet bénéfique de son inactivation dans un modèle murin de plaques amyloïdes, une des lésions caractéristiques de la maladie d’Alzheimer. Les résultats, publiés dans la revue Molecular Psychiatry, ouvrent des perspectives de recherche sur le potentiel de ce récepteur comme cible thérapeutique.
La maladie d’Alzheimer est caractérisée par la présence de lésions amyloïdes dues à des agrégats de peptides Aβ et les dégénérescences neurofibrillaires dues à l’accumulation de protéines Tau hyper-phosphorylée. Leur présence entraîne une réponse inflammatoire chronique dans le cerveau. Lorsqu’elles subissent des dommages, les cellules libèrent de l’ATP en très grande quantité. Cette forte concentration d’ATP est détectée comme un signal de danger par des récepteurs spécifiques nommés P2X7.
Un double rôle de ce récepteur, à la fois pro-inflammatoire et neuro-protecteur, a été supposé dans la maladie d’Alzheimer. Une étude conduite par l’équipe de Cécile Delarasse à l’ICM a cherché à mieux comprendre son implication dans cette pathologie. Pour cela, les chercheurs ont étudié les conséquences de l’inactivation du récepteur P2X7 dans un modèle murin de lésions amyloïdes, caractéristiques de la maladie d’Alzheimer.
Par de multiples tests comportementaux, électrophysiologiques, biochimiques et histologiques, ils montrent que l’absence du récepteur P2X7 est associée à une diminution des lésions amyloïdes et a une amélioration des fonctions cognitives et de la plasticité synaptique. Ils confirment ainsi le rôle néfaste de l’activation du récepteur dans la maladie.
« La deuxième étape a été de chercher à comprendre les mécanismes sous-jacents à ces premiers résultats. Que se passe-t-il d’un point de vue cellulaire et moléculaire au niveau de ce récepteur ? Pourquoi son absence entraine-t-elle un effet bénéfique? »
Le récepteur P2X7 s’activant dans un contexte d’inflammation et de lésions tissulaires, les chercheurs se sont intéressés aux conséquences immunitaires de son inactivation.
Ils ne montrent pas d’effet sur l’activation spécifique du système immunitaire innée : les cellules microgliales résidentes dans le système nerveux central ou le recrutement de macrophages en périphérie. En revanche, ils observent l’implication du système immunitaire adaptatif par le biais des lymphocytes T.
En l’absence du récepteur P2X7, ils observent une diminution d’expression de molécules appelées chimiokines, dont une des fonctions est d’attirer les cellules immunitaires vers un site inflammatoire, et par conséquent un plus faible recrutement de lymphocytes T dans le cerveau qui sont délétères sur les symptômes de la maladie.
« Ces résultats apportent de nouveaux éléments importants sur le rôle pathologique du récepteur P2X7 et l’effet bénéfique de son inactivation sur la pathologie amyloïde caractéristique de la maladie d’Alzheimer. Ils ouvrent des perspectives de recherche sur le potentiel de ce récepteur comme cible thérapeutique.» conclut Cécile Delarasse
Source
New role of P2X7 receptor in an Alzheimer’s disease mouse model. Elodie Martin, Majid Amar, Carine Dalle, Ihsen Youssef, Céline Boucher, Caroline Le Duigou, Matthias Brückner, Annick Prigent, Véronique Sazdovitch, Annett Halle, Jean M. Kanellopoulos, Bertrand Fontaine, Benoît Delatour, Cécile Delarasse. Molecular Pyschiatry. 2018
https://www.nature.com/articles/s41380-018-0108-3
Contact chercheuse
Cécile Delarasse
Institut de la vision
Paris
cecile.delarasse@upmc.fr
Un rôle clé pour les récepteurs CB1 astrocytaires et la D-sérine dans la mémoire
Les astrocytes sont des cellules gliales idéalement positionnées à la synapse pour participer de manière active à la communication neuronale. Tout comme les neurones, les astrocytes sont capables de libérer des molécules actives, les gliotransmetteurs, et par ce biais, de réguler activement la transmission, la plasticité synaptique à long terme et la mémoire. Cependant, les processus cellulaires et moléculaires à l’origine de ces fonctions astrocytaires restent largement inconnus. Cette étude, réalisée dans l’hippocampe de souris démontre que la signalisation dépendant des endocannabibnoïdes est nécessaire pour la reconnaissance d’un nouvel objet à travers l’activation des récepteurs astrocytaires aux endocannabinoïdes de type 1, communément appelés récepteurs CB1 astrocytaires. La stimulation de ces récepteurs régule la disponibilité en D-serine, co-agoniste indispensable à l’activité des récepteurs glutamatergiques de type NMDA jouant un rôle clé dans les phénomènes de plasticité synaptique et de mémoire. Ces résultats ont été obtenus grâce aux efforts coordonnés de nombreux chercheurs du Neurocentre Magendie à Bordeaux, en particulier l’équipe de Stéphane Oliet (Valentin Langlais, Aude Panatier) et de Giovanni Marsicano (Laurie Robin et José Cruz) qui ont partagé leur expertise sur les interactions neurone-glie, la D-serine, les propriétés physiologiques des récepteurs CB1 et l’analyse comportementale.
Référence
Robin LM, Oliveira da Cruz JF, Langlais VC, Martin-Fernandez M, Metna-Laurent M, Busquets-Garcia A, Bellocchio L, Soria-Gomez E, Papouin T, Varilh M, Sherwood MW, Belluomo I, Balcells G, Matias I, Bosier B, Drago F, Van Eeckhaut A, Smolders I, Georges F, Araque A, Panatier A, Oliet SHR, Marsicano G. Astroglial CB(1) Receptors Determine Synaptic D-Serine Availability to Enable Recognition Memory. Neuron. 2018 Jun 6;98(5):935-944.
Contact chercheur
Giovanni Marsicano
INSERM U1215, NeuroCentre Magendie, 33077 Bordeaux, France
University of Bordeaux, 33077 Bordeaux, France
Crédit photo © Charlie Padgett
Vers une compréhension de l’origine du plus fréquent des troubles de l’infertilité féminine
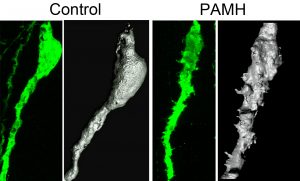
Des chercheurs de l’Inserm et de l’Université de Lille, ont découvert que le plus fréquent des troubles de la fertilité féminine – le syndrome des ovaires polykystiques (SOPK) – serait causé par la surexcitation de neurones cérébraux. La coupable : une hormone produite par les ovaires, appelée « Hormone anti-müllerienne» (AMH), surproduite chez les femmes souffrant d’un SOPK. Les travaux de l’équipe chez la souris montrent l’importance de l’exposition in utero à des taux anormalement élevés d’AMH dans l’occurrence de la maladie. Ces résultats parus dans Nature Medicine ouvrent la voie à de nouveaux concepts sur l’origine embryonnaire de la maladie ainsi qu’à de nouvelles pistes pour l’élaboration d’un traitement.
Une femme sur dix en âge de procréer souffre du syndrome des ovaires polykystiques ou « SOPK » qui se traduit par une forte surproduction par les ovaires d’hormones masculines, les androgènes, perturbant les mécanismes de croissance des follicules ovariens. Ceux-ci vont stagner en plus grand nombre (d’où l’appellation, à tort, d’ovaires polykystiques) et causer des dysfonctionnements de l’ovulation à l’origine d’une infertilité.
Si on sait aujourd’hui diagnostiquer la maladie, sa cause reste encore inconnue. Les options thérapeutiques utilisées à ce jour visent à réduire les symptômes et à prévenir des complications mais aucun traitement préventif ou curatif n’existe.
Une équipe coordonnée par Paolo Giacobini, directeur de recherche Inserm (Centre de recherche Jean-Pierre Aubert – Neurosciences et cancer, Inserm U1172/Université de Lille/CHU de Lille), met à mal l’hypothèse selon laquelle le SOPK n’altèrerait que les ovaires, en montrant qu’il modifierait également l’activité de neurones cérébraux situés dans l’hypothalamus et responsables du contrôle de la reproduction. En cause, une hormone produite par les ovaires et impliquée dans leur fonctionnement : l’hormone anti-müllerienne (AMH). Chez les patientes souffrant d’un SOPK, l’AMH présente une concentration sanguine deux à trois fois plus élevée, directement liée à la sévérité de la maladie. L’équipe de recherche a basé ses travaux sur deux constatations chez les femmes SOPK enceintes : l’une, déjà connue, est sa corrélation avec une hyperandrogénie (surproduction d’androgènes). La seconde, inédite, est sa corrélation avec une surproduction d’AMH pendant la grossesse. Les chercheurs ont montré que des souris traitées à l’AMH pendant la gestation donnent naissance à des femelles qui développent les symptômes caractéristiques du SOPK à l’âge adulte. La production de taux anormalement élevés d’AMH pendant la période prénatale pourrait donc être à l’origine d’une hyperandrogénie gestationnelle et d’une imprégnation hormonale anormale du foetus.
L’équipe a également observé que chez les souris mimant un SOPK, l’exposition in utero à des taux d’AMH anormalement élevés, était responsable, à l’âge adulte, d’une activité accrue des neurones hypothalamiques sécrétant la protéine GnRH. Cette production intense de GnRH stimule la surproduction d’une autre hormone, l’hormone lutéinisante (LH), qui elle-même stimule la production d’androgènes. Paolo Giacobini et ses collaborateurs, dont Brooke Tata et Nour El Houda Mimouni, co-premier auteurs de l’article, démontrent ici que l’exposition prénatale à l’AMH provoquerait une véritable réaction en chaîne chez la descendance : les neurones hypothalamiques se mettraient à sécréter davantage de GnRH, ce qui accroîtrait alors la production de LH par l’hypophyse et provoquerait au final cette hausse caractéristique d’androgènes dans les ovaires, à l’origine des troubles de l’ovulation observés dans la maladie.
Forts de ces observations, les chercheurs ont appliqué sur les souris mimant le SOPK un traitement spécifique « normalisant » l’action accrue de la GnRH sur la production de LH et restauré ainsi leur fertilité. Ces observations sur modèle murin offrent des perspectives thérapeutiques inédites qui restent à confirmer à l’échelle humaine.
Sources
Elevated prenatal anti-Müllerian hormone reprograms the fetus and induces polycystic ovary syndrome in adulthood
Brooke Tata, Nour El Houda Mimouni et al., (2018) Nature Medicine : doi:10.1038/s41591-018-0035-5
Contact chercheur
Dr. Paolo Giacobini
Laboratory of Development and Plasticity of the Neuroendocrine Brain
University of Lille, Inserm U1172
Building Biserte-Place de Verdun 1-59045 Lille Cedex
France
Des puces pour modéliser et mieux comprendre la maladie de Huntington.
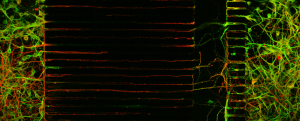
En combinant l’utilisation de neurones issus de souris modèles de la maladie de Huntington, une maladie neurologique d’origine génétique, et la technologie microfluidique, l’équipe de Frédéric Saudou, Directeur de Grenoble Institut des Neurosciences (GIN – Inserm/UGA) et responsable de l’équipe « Dynamiques intracellulaires et neurodégénérescence », en collaboration avec Benoit Charlot, de l’Institut d’électronique des systèmes (CNRS/Université de Montpellier), a reconstitué sur une puce le circuit neuronal atteint chez les patients. Cette étude qui a permis d’identifier un nouveau mécanisme pathogénique, a été publiée dans la revue Cell Reports le 2 janvier 2018.
La maladie de Huntington (MH) est une affection d’origine génétique qui concerne plus de 18000 personnes en France. Elle est caractérisée par des troubles cognitifs, psychiatriques et des mouvements incontrôlés. La MH est causée par la présence d’une répétition anormale de l’acide aminé glutamine dans la protéine huntingtine. Plus les répétitions sont nombreuses, plus les symptômes apparaissent tôt. Une des caractéristiques de la maladie est la dysfonction du circuit corticostriatal qui connecte deux régions du cerveau, le cortex et le striatum. Ces deux régions expriment la protéine mutante et dégénèrent dans la maladie de Huntington mais les mécanismes cellulaires impliqués sont encore mal compris. Jusqu’à présent, il était très difficile d’étudier les altérations du circuit avec une résolution subcellulaire.
Grace à l’approche microfluidique qui consiste à fabriquer dans un matériau biocompatible et transparent des chambres de culture et des canaux à l’échelle des cellules, les chercheurs ont pu contrôler la pousse et l’orientation des axones dans des canaux micrométriques pouvant atteindre jusqu’à 500 microns de longueur afin de reconstituer le circuit corticostriatal. Cette étude montre le rôle fondamental du cortex dans la genèse des dysfonctions au niveau du circuit entier. En effet, grâce au système microfluidique, les chercheurs ont pu isoler les neurones du cortex et du striatum dans des compartiments identifiés afin de reconstituer des circuits hybrides contenant un cortex sain avec un striatum malade, et vice versa. L’équipe a ainsi montré que des neurones de cortex malade sont suffisants pour induire les dysfonctions du circuit alors même que les neurones du striatum sont sains. À l’inverse, des neurones corticaux sains sont capables de sauver les neurones du striatum malade.
Ces travaux permettent de mieux comprendre comment la huntingtine mutante induit la dysfonction de ces deux régions du cerveau et identifie le cortex comme une cible d’importance pour empêcher la neurodégénerescence du striatum. Enfin, ce modèle représente également une nouvelle approche pour tester et valider des molécules à intérêt thérapeutique.
Référence : Virlogeux A, Moutaux E, Christaller W, Genoux A, Bruyère J, Fino E, Charlot B, Cazorla M, Saudou F. Reconstituting Corticostriatal Network On-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington’s Disease. Cell Reports. 2018 Jan 2;22(1):110-122. doi: 10.1016/j.celrep.2017.12.013.
Contact chercheur – Frédéric Saudou, Professeur CHU Université Grenoble Alpes / frederic.saudou@inserm.fr
Identification des neurones générant la paralysie corporelle pendant le sommeil paradoxal: une cible précoce dans la maladie de Parkinson ?

C’est à Lyon à la fin des années 1950 que le Professeur M. Jouvet, décédé en octobre 2017, a découvert une phase particulière du sommeil physiologique des mammifères caractérisée par une activité corticale très similaire à celle de l’éveil paradoxalement associée à une immobilité corporelle résultant d’une atonie de la musculature posturale. Ce sommeil dit « paradoxal » (SP) s’avère être le siège privilégier de l’activité onirique et mais aussi de processus complexes sous-jacents de l’apprentissage, la mémoire et l’humeur. Après plusieurs décennies de débats au sein de la communauté scientifique internationale, notre équipe du Centre de Recherche en Neurosciences de Lyon (CRNL) vient de compléter le décryptage des circuits neuronaux responsables de cette paralysie propre au SP, ouvrant de fait des champs d’investigation pour comprendre le SP physiologique et ses pathologies.
Après avoir décrit les neurones glutamate du tegmentum pontique générateurs du phénomène (Valencia Garcia et coll., Brain 2017), nous avons cette fois-ci identifié l’ultime maillon du réseau neuronal mis en jeu pendant le SP. Par une combinaison de techniques neuroanatomiques chez le rat, nous avons d’abord démontré que les neurones inhibiteurs actifs pendant le SP et afférents aux motoneurones somatiques (crâniens et spinaux) sont exclusivement localisés dans la formation réticulée ventromédiane (vmM) du bulbe rachidien, et non comme généralement admis jusqu’à maintenant dans la moelle épinière. Pour caractériser leur implication fonctionnelle supposée dans l’expression du SP, nous avons obtenu leur inactivation génétique (knockout) par l’infusion locale de vecteurs viraux (AAVs) véhiculant un short-hairpin ARN dirigé contre les ARNs du transporteur vésiculaire du GABA/glycine (vGAT-shRNA), bloquant ainsi définitivement et en quelques jours seulement la production de ce transporteur dans les neurones GABA/glycine visés. Bien qu’encore fonctionnels dans le vmM, ces neurones deviennent incapables de sécréter leurs neurotransmetteurs dans l’espace synaptique et donc d’inhiber leurs cibles post-synaptiques (i.e. les motoneurones), comme déconnectés des réseaux neuronaux auxquels ils appartiennent. Bien que profondément endormis, les paupières fermées et isolés de l’environnement, les rats ainsi traités dans la vmM ne sont plus paralysés pendant le SP (perte définitive de l’atonie musculaire) et exécutent des mouvements anormaux brusques, violents, incontrôlés, parfois coordonnés (reptation, prise alimentaire, etc), reflétant probablement l’expression de leurs rêves.
Ces données expérimentales chez le rat soutiennent le rôle prépondérant des neurones inhibiteurs de la vmM dans l’expression physiologique de l’atonie musculaire du SP. Par ailleurs, elles récapitulent finement le tableau symptomatique rapporté pendant le SP chez des patients souffrants de REM sleep Behavior Disorder (RBD), une parasomnie se manifestant dès la cinquantaine. Initialement considéré comme idiopathique, des études longitudinales récentes ont établi que le RBD est en fait sous-jacent d’une attaque synucléinopathique au sein du tronc cérébral et qu’il est un excellent marqueur prodromique à dix ans d’autres synucléinopathies, principalement la maladie de Parkinson. Ce modèle préclinique de RBD validé par notre étude constitue une base expérimentale pour aborder maintenant les mécanismes physio-pathologiques dépendants de l’a-synucléine, ciblant le réseau de l’atonie musculaire propre au SP et potentiellement recrutés lors de la conversion du RBD en maladie de Parkinson. Enfin, ce modèle, accédant directement à l’expression de l’activité onirique des rats pendant leur sommeil, permettra d’aborder la question passionnante de l’origine centrale des rêves et d’éclaircir les fonctions physiologique, cognitive et/ou psychologique du SP.
Référence
Valencia Garcia S, Brischoux F, Clément O, Libourel PA, Arthaud S, Lazarus M, Luppi PH, Fort P. Ventromedial medulla inhibitory neuron inactivation induces REM sleep without atonia and REM sleep Behavior Disorder. Nature Communications. 2018 Feb 5; 9(1):504. doi: 10.1038/s41467-017-02761-0. PMID: 29402935
Contact chercheur: Dr Patrice Fort
Equipe SLEEP – Centre de Recherche en Neurosciences de Lyon (CRNL)
CNRS UMR5292 – Université Claude Bernard Lyon1 – INSERM U1028
7-11 rue Guillaume Paradin
69372 Lyon, cedex 08, France
patrice.fort@univ-lyon1.fr
+ (33) 4 78 77 10 41 – Fax : + (33) 4 78 77 10 22
In the late 1950s, Professor M. Jouvet, who passed away in October 2017, discovered a particular phase of the mammalian sleep characterized by a cortical activity similar to that of awakening, paradoxically associated with body immobility due to a generalized muscle atonia of postural musculature. This so-called “Paradoxical Sleep” (PS) is concomitant to dreaming activity and other complex neurobiological processes underlying learning, memory and mood regulation. After several decades of debates, our team from the Lyon Neuroscience Research Center (CRNL) just completed the decoding of neuronal circuits responsible for the PS-specific paralysis, opening up new research fields to understand PS regulation and its pathologies.
After the recent description of the brainstem glutamate neurons generating the phenomenon (Valencia Garcia et al., Brain 2017), we here identified the ultimate inhibitory link recruited during PS. By a combination of neuroanatomical techniques in the rat, we first demonstrated that inhibitory neurons activated during PS and sending monosynaptic inputs to the somatic (cranial and spinal) motoneurons are located in the ventromedial part of the medullary reticular formation (vmM), and not within the spinal cord as generally assumed. To characterize their functional involvement in PS expression, we performed their genetic inactivation (knockout) by local infusion of viral vectors (AAVs) carrying short-hairpin mRNAs complementary to mRNAs encoding for the GABA/glycine vesicular transporter (vGAT), thus rapidly blocking the production of this protein in targeted medullary neurons. Still present and functional, the vmM GABA/glycine neurons became unable to release their neurotransmitters and therefore to inhibit their postsynaptic targets (i.e. motoneurons), as they were disconnected from the neuronal networks to which they belong. Although deeply asleep, with closed eyelids and isolated from environment, rats treated with vGAT-shRNA in vmM were no longer paralyzed (permanent loss of muscle atonia) during PS and executed abnormal, violent and uncontrolled movements, likely revealing some dream enactments.
These experimental data in rats support clearly the preponderant role of vmM inhibitory neurons in the physiological expression of muscle atonia during PS. In addition, they closely recapitulate the motor symptoms reported during PS in patients suffering REM sleep Behavior Disorder (RBD), a parasomnia that may occur at the age of 50. Firstly considered as an idiopathic pathology, recent longitudinal studies established that RBD is actually due to the development of a brainstem synucleinopathy and is considered to date as the best prodromal marker (» 10 years) of other synucleinopathies, as Parkinson’s disease. In that context, this preclinical RBD model may represent a basis for further experiments aimed at deciphering the physio-pathological mechanisms which are dependent of α-synuclein and which evolve over years within the brainstem for the RBD conversion to Parkinson’s disease. This model will also be of particular interest for addressing intriguing questions regarding the origin of dreams and the physiological, cognitive or psychological functions of PS.
Les nouveaux neurones de l’addiction !
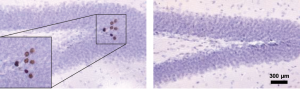
La consommation de substances psychoactives, en particulier la nicotine et la cocaïne, a des conséquences néfastes sur les fonctions cérébrales. Depuis longtemps, nous suspections que les effets de ces drogues étaient intimement liés à des altérations intervenant dans l’hippocampe adulte, une région qui présente la particularité de produire des nouveaux neurones (néo-neurones) tout au long de la vie des mammifères, l’homme inclus. Ainsi, nous avons montré que l’auto-administration de drogues diminue la production et la survie des nouveaux neurones hippocampiques de rats. Puis, nous avons émis l’hypothèse qu’une faible production de nouveaux neurones rendrait les animaux vulnérables à la pharmacodépendance (Abrous et al., 2005). Cette hypothèse reposait sur l’observation que des animaux spontanément vulnérables à l’addiction, ou des animaux devenus vulnérables après stress précoces, sont caractérisés par une faible production de nouveaux neurones. Pour tester notre hypothèse, un modèle transgénique a été développé afin de tuer les cellules en prolifération par surexpression de la protéine pro-apoptotique Bax dans les précurseurs neuronaux exprimant la protéine Nestine. Grâce à ce modèle transgénique inductible original, nous avons montré qu’une souris saine pouvait être transformée en une souris « addict ». Dans cette étude, les souris ont été entraînées à s’auto-administrer la cocaïne et nous avons montré que les souris dont la production de nouveaux neurones a été réduite par transgénèse sont plus motivées à s’auto-administrer la drogue. De plus, au cours du sevrage, elles rechutent quand elles sont re-exposées à l’environnement dans lequel elles s’étaient auto-administrées de la drogue. Ces travaux démontrent l’importance de la néo-neurogénèse hippocampique dans l’addiction et ouvrent de nouvelles perspectives sur la compréhension de la vulnérabilité à la pharmacodépendance.
Référence :
Depleting adult dentate gyrus neurogenesis increases cocaine-seeking behavior.
Deroche-Gamonet V, Revest JM, Fiancette JF, Balado E, Koehl M, Grosjean N, Abrous DN, Piazza PV.
Mol Psychiatry. 2018 Mar 5. doi: 10.1038/s41380-018-0038-0. [Epub ahead of print]
Contact chercheur:
Dr Nora Abrous
“Neurogenesis & Pathophysiology”
Neurocentre Magendie – Inserm 1215 et Université de Bordeaux
146 rue Léo-Saignat
33077 Bordeaux cedex
Tel. : +33 5 57 57 36 86
For many years, it was believed that the adult mammalian brain was composed of a fixed number of neurons that no longer divide after the end of development. However, the dentate gyrus (DG) of the hippocampus presents the unique peculiarity to produce new neurons throughout the lifespan of individuals. These adult-born dentate granule neurons (Adu-DGNs) are integrated into the hippocampal circuitry that they tightly control. They are required for learning and memory and have been proposed to be involved in drug addiction considered as a maladaptive learning. A number of studies support this hypothesis: 1) self-administration (SA) of drugs of abuse, such as nicotine or cocaine, decreases adult neurogenesis, 2) a decrease in adult neurogenesis spontaneously found in some individuals or induced by early life stress in others is associated with a higher vulnerability to drugs . Despite this compelling correlative evidence, the causal relationship between neurogenesis and vulnerability to drugs was still lacking.
To assess the role of Adu-DGNs in cocaine self-administration we developed an inducible transgenic mouse model in which the death of neural precursors can be selectively induced by over-expressing the pro-apoptotic Bax protein following doxycycline (Dox) treatment . The impact of depleting Adu-DGNs was evaluated during various phases of SA behavior: acquisition, retention and relapse in a cue-induced reinstatement (Cue R) test. Our results show that transgenic mice with decreased Adu-DGNs exhibit increased motivation to self-administer cocaine and a higher seeking response to cocaine-related cues. These results identify adult hippocampal neurogenesis as a key factor in vulnerability to cocaine addiction and suggest that targeting Adu-DGNs might constitute a novel strategy for curing or preventing drug addiction.
Un même poisson à quelques neurones hypocrétinergiques près
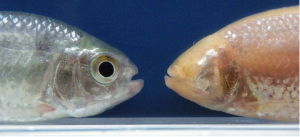
L’un est coloré et vit dans les rivières d’Amérique latine, l’autre est aveugle, dépigmenté et habite dans l’obscurité des grottes mexicaines, pourtant ce sont les mêmes poissons : Astyanax mexicanus. Des chercheurs de l’Institut des neurosciences Paris-Saclay (CNRS/Université Paris-Sud) ont recherché les mécanismes embryonnaires à l’origine de leurs différences morphologiques et comportementales.
Comment les spécimens cavernicoles ont-ils évolué afin de survivre dans un tel environnement ?
L’évolution du développement cérébral et ses conséquences comportementales est un sujet majeur pour comprendre comment les vertébrés colonisent les environnements nouveaux. Astyanax mexicanus est un modèle de choix pour aborder cette question.
Ce poisson présente deux morphotypes: une forme d’habitat de surface qui habite les rivières de l’Amérique Centrale et du Sud, et une forme cavernicole composée de plusieurs populations vivant dans l’obscurité totale et permanente des grottes mexicaines.
Les poissons cavernicoles ont évolué vers des traits régressifs – les plus spectaculaires étant la perte des yeux et de la pigmentation – mais ils ont aussi développé plusieurs traits constructifs tels qu’une mâchoire plus large, plus de papilles gustatives, ou des épithéliums olfactifs plus importants, et aussi de nombreux changement comportementaux. Parmi les plus frappants : les morphes cavernicoles dorment très peu et nagent en permanence.
Les chercheurs de l’Institut des Neurosciences Paris-Saclay (CNRS/Université Paris-Sud) ont observé qu’un nombre différent de certains neurones se développait dans l’hypothalamus chez les embryons des deux spécimens. Cette variation naturelle dans le développement cérébral impacte non seulement la morphologie des poissons cavernicoles mais aussi leur comportement.
En intervenant sur le développement neuronal des larves du poisson cavernicole, les chercheurs sont parvenus à leur faire mimer le comportement du poisson de surface. Ce travail révèle donc de nouvelles variations sous-jacentes à l’évolution et à l’adaptation des poissons cavernicoles à leur environnement extrême. Ces variations en nombres de neurones trouvent leur origine dans des processus embryonnaires très précoces, qui se produisent pendant les dix premières heures après la fécondation, lorsque l’embryon n’est encore qu’une « boule de cellules ».
Références :
Developmental evolution of the forebrain in cavefish, from natural variations in neuropeptides to behavior, Alexandre Alié, Lucie Devos, Jorge Torres-Paz, Lise Prunier, Fanny Boulet, Maryline Blin, Yannick Elipot et Sylvie Rétaux, eLife, 6 février 2018. doi.org/10.7554/eLife.32808
Contact chercheur:
Sylvie Rétaux
Institut des Neurosciences Paris-Saclay
Développement & Évolution du cerveau antérieur
retaux@inaf.cnrs-gif.fr
The same fish but a few more Hypocretin neurons
New insight into the development and function of Mexican cavefish brains reveals how the animals adapted their behaviour to cope with extreme environments.
There are two forms of A. mexicanus: surface-dwelling fish that inhabit rivers in south and Central America, and fish that live in the total and permanent darkness of Mexican caves. The cavefish display striking differences from their river-dwelling counterparts, including the loss of sleep that makes them a potential model to study human sleep disorders such as insomnia.
In a study published in eLife, researchers from the French National Center for Scientific Research (CNRS) and Université Paris-Saclay demonstrate how the developmental evolution of the brain in cave-dwelling Astyanax mexicanus (A. mexicanus) underlies the evolution of its survival behaviors. A second study from the US, published at the same time in eLife, suggests higher levels of hypocretin (HCRT) in the cavefish brain – a chemical compound associated with human narcolepsy – accounts for the loss of sleep in these animals.
“A. mexicanus cave-dwellers have developed this and other beneficial behaviors that allow them to live in adverse environments,” says senior author Sylvie Rétaux, Group Leader at CNRS, Paris-Saclay Institute of Neuroscience. “This makes them a prime model to study the evolution of brain development and its behavioral consequences, providing greater understanding of how vertebrates colonize more unusual locations.”
In their study, Rétaux and her team compared the development and natural variations of anatomy in the brains of both surface and cave-dwelling A. mexicanus embryos and larvae, highlighting specific differences in the numbers of neurons between the two forms. “We discovered a higher number of HCRT cells developing in the brains of cave-dwelling fish compared to surface-dwellers,” explains postdoctoral researcher Alexandre Alié. “By manipulating the numbers of HCRT neurons, we were able to link these to increased activity levels in the animals.” Jorge Torres-Paz, also a postdoctoral researcher at CNRS, adds: “Interestingly, we found that the variation in HCRT neuron numbers stems from very early embryonic events, which occur as early as within the first 10 hours after fertilization, when the embryo is still like a ball of cells. This suggests the mechanisms that lead to the loss of eyes could be shared in part with those that control developmental evolution of brain and behaviour, including sleep.”
These findings show that developmental evolution of the cavefish brain drives evolution in the animals’ behavior. More generally, they also support a role for HCRT in relation to sleep in other animals, providing a new system for investigating sleep differences throughout the entire animal kingdom.