Identification des neurones générant la paralysie corporelle pendant le sommeil paradoxal: une cible précoce dans la maladie de Parkinson ? par Contributeur 04.05.2018 à 08h48
C’est à Lyon à la fin des années 1950 que le Professeur M. Jouvet, décédé en octobre 2017, a découvert une phase particulière du sommeil physiologique des mammifères caractérisée par une activité corticale très similaire à celle de l’éveil paradoxalement associée à une immobilité corporelle résultant d’une atonie de la musculature posturale. Ce sommeil dit « paradoxal » (SP) s’avère être le siège privilégier de l’activité onirique et mais aussi de processus complexes sous-jacents de l’apprentissage, la mémoire et l’humeur. Après plusieurs décennies de débats au sein de la communauté scientifique internationale, notre équipe du Centre de Recherche en Neurosciences de Lyon (CRNL) vient de compléter le décryptage des circuits neuronaux responsables de cette paralysie propre au SP, ouvrant de fait des champs d’investigation pour comprendre le SP physiologique et ses pathologies.
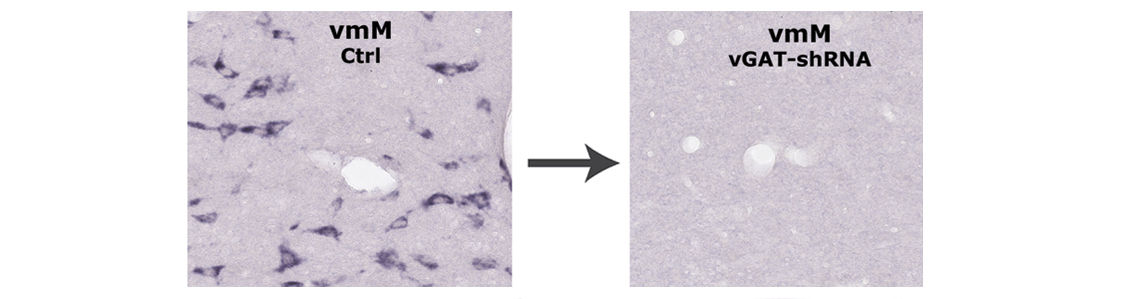
Après avoir décrit les neurones glutamate du tegmentum pontique générateurs du phénomène (Valencia Garcia et coll., Brain 2017), nous avons cette fois-ci identifié l’ultime maillon du réseau neuronal mis en jeu pendant le SP. Par une combinaison de techniques neuroanatomiques chez le rat, nous avons d’abord démontré que les neurones inhibiteurs actifs pendant le SP et afférents aux motoneurones somatiques (crâniens et spinaux) sont exclusivement localisés dans la formation réticulée ventromédiane (vmM) du bulbe rachidien, et non comme généralement admis jusqu’à maintenant dans la moelle épinière. Pour caractériser leur implication fonctionnelle supposée dans l’expression du SP, nous avons obtenu leur inactivation génétique (knockout) par l’infusion locale de vecteurs viraux (AAVs) véhiculant un short-hairpin ARN dirigé contre les ARNs du transporteur vésiculaire du GABA/glycine (vGAT-shRNA), bloquant ainsi définitivement et en quelques jours seulement la production de ce transporteur dans les neurones GABA/glycine visés. Bien qu’encore fonctionnels dans le vmM, ces neurones deviennent incapables de sécréter leurs neurotransmetteurs dans l’espace synaptique et donc d’inhiber leurs cibles post-synaptiques (i.e. les motoneurones), comme déconnectés des réseaux neuronaux auxquels ils appartiennent. Bien que profondément endormis, les paupières fermées et isolés de l’environnement, les rats ainsi traités dans la vmM ne sont plus paralysés pendant le SP (perte définitive de l’atonie musculaire) et exécutent des mouvements anormaux brusques, violents, incontrôlés, parfois coordonnés (reptation, prise alimentaire, etc), reflétant probablement l’expression de leurs rêves.
Ces données expérimentales chez le rat soutiennent le rôle prépondérant des neurones inhibiteurs de la vmM dans l’expression physiologique de l’atonie musculaire du SP. Par ailleurs, elles récapitulent finement le tableau symptomatique rapporté pendant le SP chez des patients souffrants de REM sleep Behavior Disorder (RBD), une parasomnie se manifestant dès la cinquantaine. Initialement considéré comme idiopathique, des études longitudinales récentes ont établi que le RBD est en fait sous-jacent d’une attaque synucléinopathique au sein du tronc cérébral et qu’il est un excellent marqueur prodromique à dix ans d’autres synucléinopathies, principalement la maladie de Parkinson. Ce modèle préclinique de RBD validé par notre étude constitue une base expérimentale pour aborder maintenant les mécanismes physio-pathologiques dépendants de l’a-synucléine, ciblant le réseau de l’atonie musculaire propre au SP et potentiellement recrutés lors de la conversion du RBD en maladie de Parkinson. Enfin, ce modèle, accédant directement à l’expression de l’activité onirique des rats pendant leur sommeil, permettra d’aborder la question passionnante de l’origine centrale des rêves et d’éclaircir les fonctions physiologique, cognitive et/ou psychologique du SP.
Référence
Valencia Garcia S, Brischoux F, Clément O, Libourel PA, Arthaud S, Lazarus M, Luppi PH, Fort P. Ventromedial medulla inhibitory neuron inactivation induces REM sleep without atonia and REM sleep Behavior Disorder. Nature Communications. 2018 Feb 5; 9(1):504. doi: 10.1038/s41467-017-02761-0. PMID: 29402935
Contact chercheur: Dr Patrice Fort
Equipe SLEEP – Centre de Recherche en Neurosciences de Lyon (CRNL)
CNRS UMR5292 – Université Claude Bernard Lyon1 – INSERM U1028
7-11 rue Guillaume Paradin
69372 Lyon, cedex 08, France
patrice.fort@univ-lyon1.fr
+ (33) 4 78 77 10 41 – Fax : + (33) 4 78 77 10 22
In the late 1950s, Professor M. Jouvet, who passed away in October 2017, discovered a particular phase of the mammalian sleep characterized by a cortical activity similar to that of awakening, paradoxically associated with body immobility due to a generalized muscle atonia of postural musculature. This so-called “Paradoxical Sleep” (PS) is concomitant to dreaming activity and other complex neurobiological processes underlying learning, memory and mood regulation. After several decades of debates, our team from the Lyon Neuroscience Research Center (CRNL) just completed the decoding of neuronal circuits responsible for the PS-specific paralysis, opening up new research fields to understand PS regulation and its pathologies.
After the recent description of the brainstem glutamate neurons generating the phenomenon (Valencia Garcia et al., Brain 2017), we here identified the ultimate inhibitory link recruited during PS. By a combination of neuroanatomical techniques in the rat, we first demonstrated that inhibitory neurons activated during PS and sending monosynaptic inputs to the somatic (cranial and spinal) motoneurons are located in the ventromedial part of the medullary reticular formation (vmM), and not within the spinal cord as generally assumed. To characterize their functional involvement in PS expression, we performed their genetic inactivation (knockout) by local infusion of viral vectors (AAVs) carrying short-hairpin mRNAs complementary to mRNAs encoding for the GABA/glycine vesicular transporter (vGAT), thus rapidly blocking the production of this protein in targeted medullary neurons. Still present and functional, the vmM GABA/glycine neurons became unable to release their neurotransmitters and therefore to inhibit their postsynaptic targets (i.e. motoneurons), as they were disconnected from the neuronal networks to which they belong. Although deeply asleep, with closed eyelids and isolated from environment, rats treated with vGAT-shRNA in vmM were no longer paralyzed (permanent loss of muscle atonia) during PS and executed abnormal, violent and uncontrolled movements, likely revealing some dream enactments.
These experimental data in rats support clearly the preponderant role of vmM inhibitory neurons in the physiological expression of muscle atonia during PS. In addition, they closely recapitulate the motor symptoms reported during PS in patients suffering REM sleep Behavior Disorder (RBD), a parasomnia that may occur at the age of 50. Firstly considered as an idiopathic pathology, recent longitudinal studies established that RBD is actually due to the development of a brainstem synucleinopathy and is considered to date as the best prodromal marker (» 10 years) of other synucleinopathies, as Parkinson’s disease. In that context, this preclinical RBD model may represent a basis for further experiments aimed at deciphering the physio-pathological mechanisms which are dependent of α-synuclein and which evolve over years within the brainstem for the RBD conversion to Parkinson’s disease. This model will also be of particular interest for addressing intriguing questions regarding the origin of dreams and the physiological, cognitive or psychological functions of PS.