Comment la mémoire sociale émerge à l’adolescence ?
L’adolescence est reconnue comme une période critique du développement du cerveau avec des changements majeurs des capacités cognitives et un remodelage structurel important. Les mécanismes qui sous-tendent l’émergence de nouvelles fonctions cognitives sont cependant peu connus.
Dans de nombreuses structures cérébrales, la plasticité synaptique est plus forte pendant le développement postnatal, et cette plasticité joue un rôle important dans la mise en place des réseaux neuronaux. De façon surprenante, l’équipe de Rebecca Piskorowski et Vivien Chevaleyre (Institut de Psychiatrie et Neuroscience de Paris), en collaboration avec Laure Verret et Christophe Rey de l’équipe de Claire Rampon (Centre de Recherche sur la Cognition Animale, Toulouse), a mis en évidence une forme de plasticité synaptique qui n’est pas présente au début du développement postnatal chez la souris, mais qui apparaît à la fin de l’adolescence. Cette plasticité se produit sur les interneurones exprimant la Parvalbumine de la région CA2 de l’hippocampe, une région clé pour la formation de mémoire sociale. Les auteurs ont pu montrer que l’apparition de la plasticité est liée à la maturation du réseau périneuronal (PNN : PeriNeuronal Net), une différenciation de la matrice extracellulaire. Dans de nombreuses structures, l’augmentation du PNN au cours du développement contribue à la diminution de la plasticité synaptique et à la stabilisation des réseaux. Dans CA2, ce PNN à un rôle particulier en permettant l’apparition d’une plasticité synaptique. Ceci s’explique par le fait que le PNN permet de maintenir une signalisation trans-synaptique par l’intermédiaire de la Neuréguline 1 (exprimée par les neurones pyramidaux) et son récepteur ErbB4 (exprimé par les terminaisons axonales de interneurones Parvalbumine).
L’induction de cette plasticité par les récepteurs Delta des opioïdes, aussi exprimés au niveau des terminaisons des interneurones Parvalbumine, diminue la libération de GABA. Cette dépression à long-terme de l’inhibition (iLTD), change la balance en faveur de l’excitation et permet aux afférences de CA3 de recruter les neurones pyramidaux de CA2, ce qui n’est pas le cas lorsque l’inhibition est intacte. Comme l’activité des neurones pyramidaux de CA2 est nécessaire pour la formation de mémoire sociale, nous avons émis l’hypothèse que la iLTD pourrait avoir un rôle dans cette forme de mémoire. En accord avec cette idée, nous avons montré que la mémoire sociale apparaît au cours du développement en même temps que la plasticité synaptique sur les interneurones Parvalbumine. Par ailleurs, une dégradation du PNN dans CA2, ou l’utilisation d’un système viral pour diminuer l’expression des récepteurs Delta opioïdes dans CA2, ralenti la formation de la mémoire sociale.
Ces résultats procurent un lien entre l’apparition d’une plasticité synaptique à la fin de l’adolescence et l’émergence d’une nouvelle fonction cognitive.
Référence : Domínguez S, Rey CC, Therreau L, Fanton A, Massotte D, Verret L, Piskorowski RA, Chevaleyre V. Maturation of PNN and ErbB4 Signaling in Area CA2 during Adolescence Underlies the Emergence of PV Interneuron Plasticity and Social Memory. Cell Reports. 2019 Oct 29;29(5):1099-1112.e4. doi: 10.1016/j.celrep.2019.09.044.
Contact chercheur :
Rebecca Piskorowski/Vivien Chevaleyre : Institut de Psychiatrie et Neuroscience de Paris, INSERM U1266, Paris
Laure Verret : Centre de Recherche sur la Cognition Animale, Université Paul Sabatier, Toulouse
L’origine commune des cellules souches et des cellules épendymaires multiciliées

De nouveaux neurones sont générés tout au long de la vie dans le cerveau des mammifères. Les cellules souches à l’origine de ces neurones sont localisées dans des niches neurogéniques à proximité des ventricules latéraux. La compréhension des mécanismes qui régulent la formation de ces cellules est d’un grand intérêt puisqu’elle permettra à la fois d’élucider l’origine de certaines tumeurs, mais aussi d’élaborer des stratégies régénératives à partir de ces cellules souches.
La niche neurogénique adulte est composée de deux types de cellules gliales : les cellules souches astrocytaires qui conservent une capacité proliférative, et les cellules épendymaires multiciliées qui forment une barrière épithéliale entre les cavités ventriculaires et le parenchyme. Ces cellules épendymaires sont post-mitotiques et dotées de nombreux cils motiles, dont les battements coordonnés permettent la diffusion des morphogènes et des facteurs de croissance, et l’élimination des toxines contenus dans le liquide céphalo-rachidien (LCR) et à la surface des parois ventriculaires. Mis à part leur localisation au sein de la niche neurogénique, tout oppose donc ces deux types cellulaires puisqu’elles ne partagent ni leur morphologie, ni leur fonction. De façon surprenante, notre publication récente a permis de révéler qu’elles ont une chose en commun : leur mère !
Par des techniques de traçage génétique à long terme (plusieurs semaines), nous avons suivi des progéniteurs embryonnaires et etudié leurs descendances. La technique Brainbow colore de façon unique un grand nombre de clones qui peuvent être distinguables par l’analyse automatique informatisée des couleurs des cellules de la niche neurogénique. A l’inverse, la technique MADM (Mosaic Analysis of Double Markers) confère à un petit nombre de progéniteurs, la capacité de transmettre les couleurs verte et rouge à chacun de ses lignages fils. Le faible nombre de cellules marquées par la technique MADM permet de suivre sans ambiguité les modes de division (symmétrique ou asymmétrique), le nombre de division, la distance entre les cellules d’un clone, et l’identité des cellules. L’analyse des nombreux clones obtenus grâce à la technique Brainbow permet quant à elle d’obtenir des résultats statistiques robustes. Nos observations montrent que les cellules de la niche neurogénique adulte sont issues de la division asymmétrique d’un progéniteur embryonnaire qui produirait d’abord les cellules souches maintenues à l’état quiescent, puis les cellules épendymaires post-mitotiques. Nous avons de plus montré le rôle déterminant des protéines de la famille Geminin sur la composition des clones et donc sur le destin des progéniteurs embryonnaires. La famille Geminin est composée de 3 membres, connus pour réguler la réplication de l’ADN au cours du cycle cellulaire. GemC1 et MCIDAS, qui participent au complexe de pré-réplication de l’ADN, favorisent la production des cellules épendymaires au détriment des cellules souches adultes. A l’inverse, Geminin, qui inhibe la re-réplication de l’ADN en phase G2 du cycle cellulaire favorise la production des cellules souches adulte par division symmétrique des progéniteurs embryonnaires. Les cascades d’évenements par lesquels les protéines Geminin orientent le destin des progéniteurs sont inconnues et il reste à vérifier si ces facteurs agissent via la réplication de l’ADN et le cycle cellulaire ou de façon indépendante. A terme, ces recherches permettront d’élucider l’origine des cellules souches neurales adultes et de certaines tumeurs cérébrales.
Référence :
Ortiz-Álvarez G, Daclin M, Shihavuddin A, Lansade P, Fortoul A, Faucourt M, Clavreul S, Lalioti ME, Taraviras S, Hippenmeyer S, Livet J, Meunier A, Genovesio A, Spassky N. Adult Neural Stem Cells and Multiciliated Ependymal Cells Share a Common Lineage Regulated by the Geminin Family Members. Neuron, 102(1):159-172.
Contact :
Institut de Biologie de l’Ecole Normale Supérieure (IBENS), Ecole Normale Supérieure, CNRS, INSERM, PSL Université Paris, 75005 Paris, France.
Un neurone pour une mémoire
Le phénomène de neurogenèse adulte présent chez un certain nombre de mammifères fournit un apport permanent de nouveaux neurones à certaines régions du cerveau et plus particulièrement au système olfactif. Nous savions que ces nouveaux neurones étaient impliqués dans la formation et le maintien de la mémoire olfactive. Il restait cependant à déterminer comment ce renouvellement continu de nouveaux neurones pouvait d’une part assurer la stabilité de la mémoire déjà acquise et d’autre part préserver une flexibilité pour la formation de nouvelles mémoires.
Dans cette étude, nous révélons que lorsque le délai entre deux apprentissages olfactifs est court, les nouveaux neurones qui permettent le premier apprentissage sont très sensibles aux interférences et de ce fait, sont appelés à mourir lors du deuxième apprentissage, ce qui conduit à l’oubli de cette première mémoire. Dans ce contexte, nous avons utilisé la technique d’optogénétique qui permet grâce à la lumière de moduler sélectivement l’activité des neurones ciblées et nous montrons que si l’activité de ces nouveaux neurones est bloquée, la mémoire du premier apprentissage est affectée sans avoir de conséquence sur celle formée lors du deuxième. Ce résultat suggère que ces nouveaux neurones ne pourraient servir de support qu’à un seul souvenir olfactif. Par contre, lorsque l’information mémorisée reste utile à l’animal, au-delà de phase d’apprentissage, les nouveaux neurones survivent et la mémoire est conservée. Enfin, lorsqu’un délai plus long est permis entre les deux apprentissages, une résilience accrue des nouveaux neurones aux interférences est observée et les mémoires acquises successivement sont conservées. En conclusion, les nouveaux neurones réguleraient le caractère transitoire ou persistant d’une mémoire en fonction du délai entre deux apprentissages et de la pertinence des informations apprises.
Référence:
Jérémy Forest, Mélissa Moreno,Matthias Cavelius, Laura Chalençon, Anne Ziessel, Joëlle Sacquet, Marion Richard, Anne Didier and Nathalie Mandairon. Short-term availability of adult-born neurons for memory encoding. Nat Commun. 2019; 10: 5609. Dec 6. doi: 10.1038/s41467-019-13521-7.
Contact chercheur:
INSERM, U1028; CNRS, UMR5292; Lyon Neuroscience Research Center, Neuroplasticity and Neuropathology of Olfactory Perception TeamClaude Bernard University-Lyon1 and University of Lyon, Lyon, F-69000, France.
Prix Inserm 2019 – Hervé Chneiweiss, Prix OPECST-Inserm pour l’impact sociétal

Avec ce prix, l’Institut récompense les efforts de valorisation de la recherche et sa capacité à être véritablement en dialogue avec les attentes de la société et les questions des citoyens sur leur santé. Président du comité d’éthique de l’Inserm, Hervé Chneiweiss est reconnu pour son travail sur les astrocytes dont il a démontré les fonctions. Ses travaux, à la frontière de la neurologie et de la génétique l’ont très vite amené à s’intéresser à la bioéthique et à la question de la place de la science dans la société. Conseiller au cabinet du ministre de la Recherche de 2000 à 2002, il a notamment été en charge de la première révision des lois de bioéthique. L’Inserm, ainsi que l’’Office parlementaire d’évaluation des choix scientifiques et techniques, dont il a été membre du comité scientifique, souhaitent rendre hommage à la carrière de celui qui, élu en juillet à la présidence du comité international de bioéthique de l’Unesco, porte désormais cet engagement hors de nos frontières.
Urgence Horizon Europe : où sont les neurosciences ?

Bien que le mot « Cerveau » soit souligné à quelques endroits, la thématique « Brain Health » et la recherche sur le cerveau ne sont pas mentionnées dans le texte de partenariat de la Commission européenne pour la prochaine période de programmation intitulé Horizon Europe.
Pour la dernière fois probablement, le texte d’orientation vers un éventuel plan stratégique Horizon Europe est ouvert pour consultation jusqu’au 17 novembre sur le site de l’Union européenne.
À ce stade, les partenariats sont répertoriés pour le cluster Santé et il est entendu que les partenariats non répertoriés ne seront pas mis en œuvre dans la première moitié d’Horizon Europe.
C’est pourquoi nous vous demandons de vous exprimer pour la recherche sur le cerveau, et nous suggérerons de déposer des remarques sur l’absence d’appels à projets sur les recherches collaboratives sur le cerveau et le manque de structuration dans le domaine de la recherche en neurosciences dans le texte d’Horizon Europe.
Nous attendons avec impatience toute action visant à sauver Brain Health et la recherche en neurosciences.
Merci de répondre dans ce sens au questionnaire.
L’isolation des calculs corticaux pendant les ondes delta permet la consolidation de la mémoire
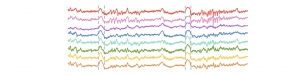
Pendant la majeure partie de notre temps de sommeil, notre cortex alterne entre des périodes
d’intense activité et des périodes de silence généralisé. Ces périodes de silence forment de grandes
déviations sur les enregistrements électro-encéphalographiques, qu’on nomme « ondes delta », et qui
jouent un rôle fondamental dans la mémoire : elles permettent de stabiliser les souvenirs à long
terme, notamment grâce à leur couplage avec d’autres rythmes cérébraux. Pourtant, les mécanismes
sous-jacents demeurent énigmatiques : comment des périodes de silence généralisé permettent-elles
aux circuits corticaux de se réorganiser pour consolider la mémoire ?
Pour bien prendre la mesure de cette énigme, nous devons revenir un instant sur ce que nous savons
de l’activité du cerveau pendant le sommeil à ondes lentes. La plupart de nos connaissances sur les
mécanismes fins nous viennent de travaux menés chez le rongeur. Nous savons tout d’abord que
l’hippocampe, la structure cérébrale qui permet entre autres de former de nouveaux souvenirs, se
réactive spontanément en générant une activité semblable à celle de l’éveil : comme si l’animal
« rêvait » de ce qu’il vient de vivre pendant l’expérience scientifique à laquelle il a participé. Ces
informations sont transmises au cortex, qui répond en activant des sous-groupes de neurones bien
spécifiques. Souvent, ce dialogue est suivi d’une onde delta et d’une activité rythmique appelée
« fuseau de sommeil » : c’est à ce moment semble-t-il que les circuits corticaux se réorganisent pour
former des souvenirs stables. Mais alors, pourquoi le dialogue hippocampo-cortical est-il interrompu
par une période de silence (onde delta) juste avant que les circuits corticaux ne puissent prendre en
compte ces échanges pour se réorganiser ? Ce silence n’efface-t-il pas les informations pertinentes ?
En examinant les ondes delta de plus près, nous avons tout d’abord constaté que contrairement à
l’idée généralement acceptée par la communauté scientifique, le cortex ne devenait pas totalement
silencieux : à chaque onde delta, un petit nombre de neurones sans cesse changeant restaient actifs.
Et il ne s’agissait pas d’un simple bruit de fond : de façon surprenante, nous avons découvert que
ces neurones formaient ce que les chercheurs nomment des « assemblées » — des ensembles de
neurones qui s’activent ensemble et de manière répétée pour permettre au cortex de coder des
informations. Plus étonnant encore, ces assemblées se formaient en réponse aux réactivations
spontanées de l’hippocampe. Cette observation inattendue suggérait qu’elles pouvaient être
impliquées dans la consolidation de la mémoire. Et de fait, ces assemblées contenaient
principalement des neurones qui avaient été particulièrement impliqués dans la tâche de
mémorisation que les rats avaient accomplie juste avant la période de sommeil. L’onde delta serait-elle
donc une période de silence sélectif, où la majorité des neurones deviennent silencieux pour ne
pas perturber une minorité de neurones qui joueraient un rôle fondamental à un moment-clef ? Pour
en avoir le coeur net, nous avons adapté la tâche de mémoire spatiale pour que les rats ne se
souviennent pas de leur expérience le lendemain. Puis nous avons provoqué des ondes delta
artificielles au bon moment, pour isoler des neurones associés aux réactivations hippocampiques, ou
quelques dizaines de millisecondes plus tard, pour isoler d’autres neurones au hasard. Résultat :
lorsque nous avons isolé les bons neurones, et seulement dans ce cas, les rats ont pu stabiliser leurs
souvenirs et ont parfaitement réussi le test le lendemain.
Ces résultats suggèrent donc une profonde révision de notre compréhension du cortex : les ondes
delta ne seraient pas des périodes de silence généralisé où le cortex devient inactif et se repose, mais
un moyen d’isoler très sélectivement des assemblées de neurones choisies, qui génèrent et
maintiennent une information cruciale entre les périodes de dialogue hippocampo-cortical et de
réorganisation des circuits corticaux, pour former des souvenirs à long terme.
Référence
Todorova R, Zugaro M. Isolated cortical computations during delta waves support memory consolidation. Science. 2019 Oct 18;366(6463):377-381. doi: 10.1126/science.aay0616.
Contact chercheur
Center for Interdisciplinary Research in Biology (CIRB), Collège de France, CNRS, INSERM, Université PSL, Paris, France. michael.zugaro@college-de-france.fr
Un nouveau mécanisme pour comprendre l’instabilité des circuits neuronaux dans la maladie d’Alzheimer
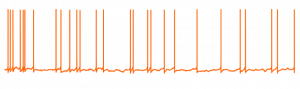
Il existe un consensus croissant sur le fait que la maladie d’Alzheimer (MA) implique une défaillance de la machinerie homéostatique, qui est à la base de la stabilité de l’activité des circuits neuronaux. Pendant le développement de la MA, ces circuits neuronaux deviennent instables, en particulier dans une structure nécessaire pour la mémorisation des souvenirs nommée l’hippocampe. Les mécanismes à l’origine de cette instabilité demeurent peu clairs.
La protéine APP, précurseur du peptide amyloïde qui s’agrège sous forme de plaques, est au cœur de la pathogenèse de la MA. Dans une étude précédente, Paula Pousinha et ses collègues de l’équipe de Jacques Barik et Hélène Marie (IPMC, Nice), ont montré qu’un des fragments de l’APP nommé AICD pouvait modifier l’intégration du signal envoyé à la synapse (Pousinha et al. Elife 2017). Dans cette nouvelle étude, les chercheurs ont voulu savoir si ce fragment AICD contribuait aussi à la perturbation de l’activité des circuits neuronaux de l’hippocampe, contribuant ainsi à la perturbation des processus de mémorisation.
Combinant des techniques cellulaires, électrophysiologiques, computationnelles et comportementales, ces chercheurs ont identifié un nouveau mécanisme pathologique lié à l’AICD, dont les niveaux augmentent dans la MA. Lorsque les taux d’AICD s’accroissent dans les neurones, ces derniers ont plus de mal à être activés. Les canaux ioniques modifiés par l’AICD ont été identifiés, tous étant importants pour le contrôle de la stabilité des circuits neuronaux. Cet effet dépend de la transcription. De plus, cette altération dépendante d’AICD modifie l’activité oscillatoire de l’hippocampe, en particulier dans la gamme des g-fréquences hautement impliquée dans les processus de mémorisation. Enfin, dans un modèle murin dans lequel l’expression d’AICD est augmentée dans l’hippocampe, la mémoire est altérée.
Collectivement, ces données suggèrent que les niveaux pathologiques de l’AICD, déjà observés chez des patients humains de la MA, pourraient contribuer à une défaillance de l’homéostasie des circuits neuronaux, entraînant le passage du vieillissement normal à la MA.
Référence :
Pousinha PA, Mouska X, Bianchi D, Temido-Ferreira M, Rajão-Saraiva J, Gomes R, Fernandez SP, Salgueiro-Pereira AR, Gandin C, Raymond EF, Barik J, Goutagny R, Bethus I, Lopes LV, Migliore M, Marie H.The Amyloid Precursor Protein C-Terminal Domain Alters CA1 Neuron Firing, Modifying Hippocampus Oscillations and Impairing Spatial Memory Encoding.Cell Rep. 2019 Oct 8;29(2):317-331.e5. doi: 10.1016/j.celrep.2019.08.103.
Pour en savoir plus :
Pousinha PA, Mouska X, Raymond EF, Gwizdek C, Dhib G, Poupon G, Zaragosi LE, Giudici C, Bethus I, Pacary E, Willem M, Marie H. Physiological and pathophysiological control of synaptic GluN2B-NMDA receptors by the C-terminal domain of amyloid precursor protein. Elife. 2017 Jul 6;6. pii: e25659. doi: 10.7554/eLife.25659. PubMed PMID: 28682239; PubMed Central PMCID: PMC5544428.
Contact chercheur :
Paula Pousinha
Institut de Pharmacologie Moléculaire et Cellulaire
Cnrs, Université de Nice Sophia Antipolis, Nice, France.
pousinha@ipmc.cnrs.fr
Pétition adressée à la Commission Européenne

La Société des Neurosciences exprime son soutien à la lettre ouverte demandant à la Commission Européenne la révision du titre de la mission de la commissaire Mariya Gabriel pour que les champs de la recherche et de l’éducation y soient représentés de façon explicite comme des priorités et non pas compris dans « Innovation et Jeunesse » .
Si vous souhaitez signer cette pétition, cliquez ici
Date limite : 23 octobre 2019
Le recyclage cellulaire contre la mort neuronale

Les synucléinopathies sont des maladies neurodégénératives caractérisées par l’accumulation d’une protéine appelée α-synucléine sous forme agrégée au sein des cellules du système nerveux central. La maladie de Parkinson est la synucléinopathie la plus répandue, avec une accumulation de l’α-synucléine localisée au sein des neurones. L’atrophie multisystématisée est la seconde synucléinopathie la plus répandue, caractérisée par l’accumulation de l’α-synucléine au sein des cellules protectrices des neurones, appelées oligodendrocytes. L’accumulation de cette protéine sous forme pathologique dans ces cellules joue un rôle important dans la mort des neurones. Dans cet article, nous avons adopté une stratégie thérapeutique ayant pour but d’augmenter l’élimination de l’α-synucléine grâce à l’activation d’un des systèmes de dégradation des protéines, appelé autophagie, par l’intermédiaire de la protéine TFEB. Pour ce faire, nous avons ciblé spécifiquement les cellules affectées dans des modèles animaux de la maladie de Parkinson et d’atrophie multisystématisée. Nous avons démontré qu’un ciblage spécifique dans les neurones pour la maladie de Parkinson et dans les oligodendrocytes pour l’atrophie multisystématisée s’avère être une stratégie efficace pour protéger la mort des neurones. Ainsi, nous avons pu montrer pour la première fois l’intérêt de jouer sur sa dégradation et de cibler spécifiquement les cellules où l’α-synucléine s’agrège comme piste thérapeutique intéressante pour ces maladies neurodégénératives.
Synucleinopathies are neurodegenerative diseases characterized by the cellular accumulation of a protein called α-synuclein, in its misfolded conformation, into the central nervous system. Parkinson’s disease is the most common synucleinopathy, characterized by a neuronal α-synuclein accumulation while Multiple System Atrophy, the second most prevalent synucleinopathy, is characterized by the accumulation of the protein in the oligodendrocytes, the neuronal protective cells. Misfolded α-synuclein cellular accumulation plays a major pathological role in neuronal cell loss. In this article, we adopted a strategy aiming to increase α-synuclein clearance via the activation of the protein degradation machinery – called autophagy – in the affected cells using rodent models of Parkinson’s disease and Multiple System Atrophy. We showed that targeting the neuronal cells for Parkinson’s disease or the oligodendrocytes for Multiple System Atrophy cases is an efficient strategy to induce neuroprotection. Thus, we demonstrated for the first time that targeting α-synuclein degradation in a cell-specific way according to the synucleinopathy, is a promising therapeutic strategy for these neurodegenerative diseases.
Pour en savoir plus:
Arotcarena ML, Bourdenx M, Dutheil N, Thiolat ML, Doudnikoff E, Dovero S, Ballabio A, Fernagut PO, Meissner WG, Bezard E, Dehay B. Transcription factor EB overexpression prevents neurodegeneration in experimental synucleinopathies. JCI Insight. 2019 Aug 22;4(16). pii: 129719. doi: 10.1172/jci.insight.129719.
Contact chercheur:
Benjamin Dehay, Ph.D
Institut des Maladies Neurodégénératives (IMN), CNRS UMR 5293, Université de Bordeaux
benjamin.dehay@u-bordeaux.fr
Réguler le métabolisme du cholestérol protège les neurones
Le cholestérol participe à des fonctions essentielles du cerveau, et des dysfonctions de son métabolisme sont observées dans plusieurs maladies neurodégénératives. Dans cette étude, publiée dans la revue Brain, les chercheurs ont restauré, par thérapie génique, une enzyme de régulation du métabolisme du cholestérol et ont mis en évidence les propriétés neuroprotectrices de cette enzyme dans un modèle murin de la maladie de Huntington.
Le cholestérol est un composant fondamental pour le bon fonctionnement des différents types cellulaires du cerveau. Ce lipide est important au moment du développement embryonnaire et tout au long de la vie post-natale et adulte puisqu’il est un élément de base des membranes cellulaires. En structurant celles-ci, il permet aux neurones de communiquer entre eux et d’assurer leurs fonctions, notamment pour des processus essentiels tels l’apprentissage et la mémoire. Contrairement aux organes périphériques qui peuvent utiliser le cholestérol alimentaire et celui produit par le foie, le cerveau doit synthétiser son propre cholestérol, car ce lipide ne peut pas passer la barrière hémato-encéphalique. Cette spécificité nécessite une régulation très fine du métabolisme du cholestérol au sein du cerveau ; toute dérégulation de sa synthèse et/ou de sa dégradation provoque des dysfonctionnements cellulaires importants, pouvant conduire à des maladies neurodégénératives.
La Maladie de Huntington (MH) est une maladie génétique héréditaire, conduisant à une neurodégénérescence progressive qui commence 15 ans avant les premiers symptômes. Les patients souffrent de troubles moteurs (chorée…), cognitifs et psychiatriques, cependant les seuls traitements actuellement disponibles n’ont pour cibles que les symptômes, sans guérir la maladie. La maladie est due à la mutation – des expansions anormales de « triplets CAG » – au niveau du gène codant la Huntingtine, ce qui conduit à de nombreuse dysfonctions neuronales.
Les chercheurs avaient précédemment montré que l’enzyme CYP46A1, qui dégrade le cholestérol en excès dans les neurones, est déficiente dans le cerveau des patients atteints de la MH, mais aussi dans des modèles murins de la MH. Sa restauration, par des approches de thérapie génique, permet de rétablir le métabolisme du cholestérol, protège le cerveau de la neurodégénérescence, et rétablit des fonctions motrices normales chez un modèle murin de la MH.
Dans cette étude, les chercheurs ont élucidé les mécanismes précis qui président à cette neuroprotection. Ainsi, la restauration de CYP46A1 permet, dans un modèle murin de la MH, de réguler la transmission neuronale, l’expression de nombreux gènes importants pour la survie neuronale, ainsi que l’élimination de la protéine Huntingtine mutée agrégée, toxique pour les cellules. Ces résultats mettent donc en évidence de nouveaux mécanismes neuroprotecteurs de CYP46A1, associés à une régulation du cholestérol au sein du cerveau, avec une compensation de nombreuses dysfonctions cellulaires associées à l’évolution lente de la maladie.
Pour en savoir plus:
Kacher R, Lamazière A, Heck N, Kappes V, Mounier C, Despres G, Dembitskaya Y, Perrin E, Christaller W, Sasidharan Nair S, Messent V, Cartier N, Vanhoutte P, Venance L, Saudou F, Néri C, Caboche J, Betuing S. CYP46A1 gene therapy deciphers the role of brain cholesterol metabolism in Huntington’s disease. Brain. 2019 Aug 1;142(8):2432-2450. doi: 10.1093/brain/awz174. PubMed PMID: 31286142.
Contact chercheur:
Neurosciences Paris Seine/IBPS. CNRS/INSERM/SU
7 quai Saint Bernard, Paris 75005