UNE NOUVELLE BOITE A OUTIL POUR EXPLORER LA DYNAMIQUE DES RECEPTEURS DANS LE CERVEAU par Contributeur 07.09.2022 à 05h48
Les progrès sur la compréhension du fonctionnement du cerveau sont intrinsèquement liés aux progrès des méthodes d’investigation. La dynamique des récepteurs de neurotransmetteurs joue un rôle déterminant dans le fonctionnement des synapses et nécessite de nouvelles approches pour être étudiée au niveau de tissus cérébraux intacts. Nous rapportons dans Science Advances le développement d’une boite à outil complète depuis un nouveau modèle animal et un instrument d’imagerie jusqu’aux techniques de marquage et de contrôle de la dynamique des récepteurs qui permet de marquer par fluorescence et manipuler le mouvement des récepteurs dans le cerveau.
Les récepteurs de neurotransmetteurs sont concentrés dans les synapses en face des zones de libération du neurotransmetteur. C’est ce qui permet une transmission synaptique rapide et fidèle. Depuis 20 ans, notre laboratoire en premier en collaboration avec celui d’Antoine Triller, puis de nombreux autres, ont établis que ces récepteurs ne sont en fait pas immobiles dans les synapses mais sont en fait en grande partie très mobiles et échangent en permanence entre les zones synaptiques et extrasynaptiques par diffusion aléatoire (brownienne). C’est un savant équilibre entre cette mobilité et la stabilisation réversible des récepteurs aux synapse par interaction avec des protéines d’échafaudage qui détermine le nombre de récepteurs à la synapse, et détermine ainsi l’efficacité de la transmission synaptique. De plus, de nombreux travaux menés par notre laboratoire et d’autres ont permis de dévoiler l’extrême régulation à laquelle sont soumise ces processus et leurs rôles déterminant dans divers processus physiopathologiques. Nous avons par exemple récemment établi que la diffusion-stabilisation des récepteurs du neurotransmetteur glutamate de type AMPA est indispensable pour la potentiation des synapses glutamatergiques en réponse à une forte activité synaptique. Ce processus, appelé potentialisation à long terme, semble être un des substrat cellulaire majeur des phénomène de mémoire et d’apprentissage. En support de cet hypothèse, nous avons d’ailleurs établi que le blocage de la mobilité des récepteurs empêche la formation de certaines formes de mémoire. Dans un autre registre, une mobilité anormale des récepteurs semble être impliquée dans les déficits mnésiques observés dans différentes pathologies telles que les maladies d’Alzheimer ou de Huntington.
Il est donc très important de pouvoir étudier ces processus de mobilité des récepteurs et les contrôler, dans un contexte aussi proche de la réalité physiologique. Cependant, les techniques d’imagerie et les outils moléculaires nécessaires pour l’étude de ces phénomènes de mobilité sont depuis longtemps restés essentiellement limités à des systèmes expérimentaux réducteurs que sont les cultures dissociées de neurones. Ces systèmes, même s’ils présentent un intérêt certain, ne reproduisent pas l’intégralité de la complexité d’un tissus nerveux, manquant en particulier de reproduire l’environnement cellulaire et la connectivité du cerveau intact.
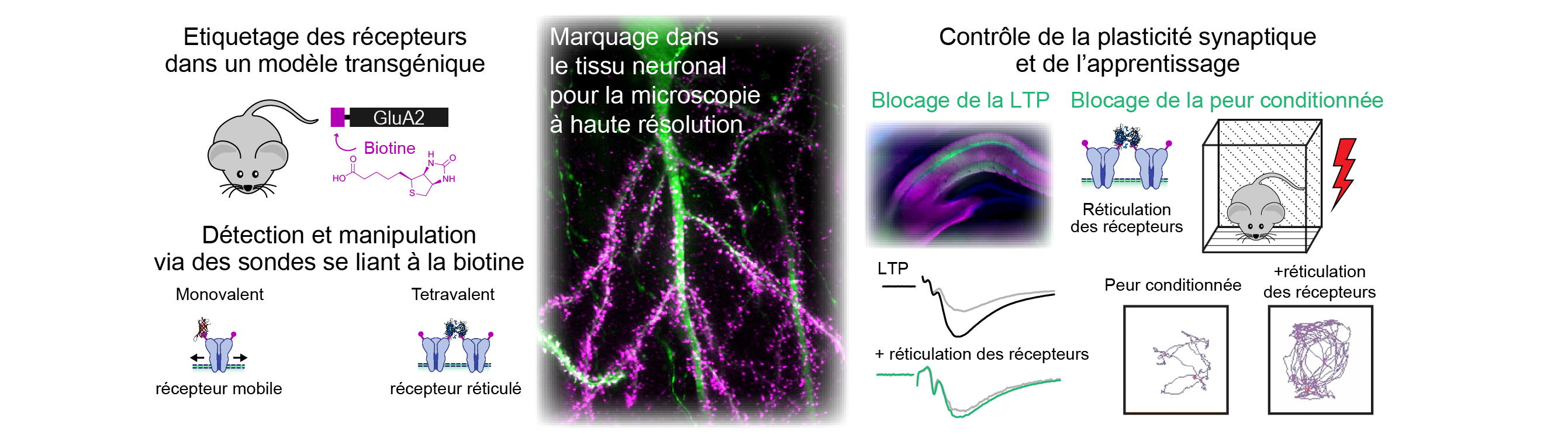
Dans le travail publié dans Science Advances, nous avons développé un nouveau modèle de souris génétiquement modifiée et une panoplie d’outils moléculaire et un instrument d’imagerie qui nous permettent maintenant de dépasser cette limite et mesurer et manipuler la mobilité des récepteurs dans le tissus cérébral intact, jusqu’à in vivo. En utilisant le modèle des récepteurs AMPA du glutamate, qui sont sous-jacents à la transmission excitatrice dans le cerveau, nous avons utilisé une technique d’étiquetage de la sous-unité GluA2 de ces récepteur avec une séquence peptidique qui permet l’ajout un résidu biotine en présence de l’enzyme biotine ligase. Dans le modèle de souris que nous avons développé, toutes les sous-unités GluA2 sont étiquetées, mais sont uniquement biotinylée dans les neurones dans lesquels nous exprimons la biotine ligase. La puissance de cette méthode permet de réaliser un marquage spécifique des récepteurs dans des populations de neurones déterminées. Ce marquage spécifique nous donne d’une part accès à l’utilisation de techniques d’imagerie à haute résolution dans les tissus, et d’autre part nous permet de contrôler la mobilité des récepteurs à l’aide de ligands multivalents de la biotine. Nous présentons de ce point de vue le développement d’une nette amélioration de la technologie d’imagerie par feuille de lumière, qui permet de mesurer la mobilité des récepteurs endogènes dans des tranches de cerveau. Nous appliquons cet ensemble de technologies pour établir que les récepteurs de types AMPA endogènes sont bien mobiles dans le tissus cérébral, ainsi que nous l’avions prédit à partir de nos travaux sur cellules en culture, et que cette mobilité est indispensable pour la potentialisation à long terme et certaines formes de mémoire conditionnelle. Ce nouveau modèle expérimental et cette boite à outil va nous permettre d’une part d’explorer les propriétés et le rôle de la mobilité des récepteurs AMPA et pourra d’autre part être appliquée à tout un ensemble d’autres protéines membranaires tels que d’autres types de récepteurs, canaux ioniques ou des protéines d’adhésion.
Figure: Un modèle de souris transgénique permet la biotinylation enzymatique spécifique des sous-unités endogènes des récepteurs du glutamate. Leur mobilité à la membrane plasmique peut être mesurée ou contrôlée dans le tissu cérébral à l’aide de protéines fluorescentes de liaison à la biotine. La réticulation de ces protéines permet un contrôle spécifique de la plasticité synaptique et du comportement des animaux.
English summary:
Advances in understanding how the brain works are intrinsically linked to advances in experimental methods. Neurotransmitter receptor dynamics play a key role in tuning synapse function and require new approaches to be studied at the level of intact brain tissue. In Science Advances, we report the development of a complete toolkit, from a new animal model and imaging instrumentation to molecular techniques for labeling and controlling the dynamics of receptors, that allow fluorescent labeling and manipulation of the movement of endogenous glutamate receptors in the brain.
Figure: A biotin acceptor peptide tag (AP tag) knock-in mouse model allows target-specific enzymatic biotinylation of endogenous glutamate receptor subunits. Their surface diffusion dynamics can be measured or controlled in brain tissue using fluorescent biotin binding proteins (BBP). Crosslinking with BBP allows for target-specific control of synaptic plasticity and animal behavior.
Contact chercheurs
Directeur de recherche au CNRS
Institut Interdisciplinaire de Neurosciences et Bordeaux Imaging Center
146 rue Léo Saignat, 33076 Bordeaux Cedex
Directeur de recherche au CNRS
Institut Interdisciplinaire de Neurosciences
146 rue Léo Saignat, 33076 Bordeaux Cedex