FORMATION DE LA MEMOIRE SOCIALE : PLASTICITES EN CASCADE DANS L’HIPPOCAMPE par Contributeur 19.09.2022 à 03h28
La cognition sociale est une fonction importante pour de nombreuses espèces qui est altérée lors de maladies psychiatriques et neurodégénératives. Bien que l’hippocampe et en particulier la région CA2 soient connus pour jouer un rôle clé dans la formation de mémoire sociale, les mécanismes cellulaires impliqués ne sont pas connus.
Dans une étude récente réalisée sur des souris, nous décrivons comment deux plasticités synaptiques de la transmission inhibitrice dans CA2 pourraient être déclenchées afin de coder l’identité d’une nouvelle souris et d’en former une mémoire à long-terme.
Plus précisément, nous montrons comment l’exposition d’une souris à un nouvel individu induit tout d’abord une dépression à long-terme de la transmission inhibitrice des interneurones exprimant la parvalbumine par l’intermédiaire de récepteurs delta-opioïdes. La diminution de la transmission inhibitrice permet ensuite aux neurones principaux de CA2 de générer des potentiels d’actions et d’induire une deuxième dépression à long-terme de la transmission inhibitrice par l’activation des récepteurs cannabinoides de type I (CB1) sur les interneurones exprimant la cholécystokinine. Le blocage des récepteurs CB1 dans la région CA2 empêche complètement la formation de mémoire sociale. Par ailleurs, la plasticité dépendante des récepteurs CB1 est fortement diminuée sur un modèle murin de schizophrénie, qui a aussi un fort déficit de mémoire sociale. Enfin, une manipulation pharmacologique de l’excitabilité des neurones principaux de CA2, qui était connue pour améliorer la mémoire sociale sur ces souris, restaure aussi la plasticité induite par les récepteurs CB1.
Ces résultats montrent l’importance de l’interaction entre deux plasticités inhibitrices dans la formation de mémoire sociale et offrent de nouvelles perspectives de traitement dans des pathologies avec altération de la cognition sociale.
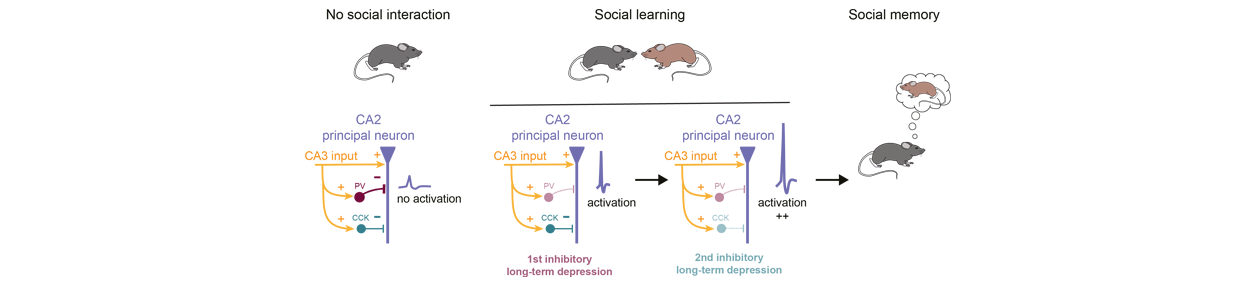
Légende de la figure:
En condition basale, la transmission synaptique entre les neurones pyramidaux CA3 et CA2 est dominée par une importante inhibition de type ‘feed-forward’ empêchant les neurones pyramidaux de CA2 de déclencher des potentiels d’action (PA). Lorsqu’une souris est exposée à une nouvelle souris, une dépression à long terme de la transmission inhibitrice des interneurones exprimant la parvalbumine (PV-IN) est induite par l’activation des récepteurs Delta-opioïdes (DOR-iLTD). Cette désinhibition permet aux PN de CA2 de générer des PA en réponse à l’activation des entrées de CA3. Après une exposition ultérieure à la nouvelle souris, les PN qui déclenchent suffisamment de PA expriment une deuxième iLTD médiée par l’activation des récepteurs cannabinoïdes de type I (CB1R-iLTD), ce qui augmente encore le déclenchement de PA dans ces PN.
Réference :
Sequential inhibitory plasticities in hippocampal area CA2 and social memory formation.
Loisy M, Bouisset G, Lopez S, Muller M, Spitsyn A, Duval J, Piskorowski RA, Verret L, Chevaleyre V. Neuron. 2022; 110(17):2854-66 doi: 10.1016/j.neuron.2022.06.013.
Contacts :
Vivien Chevaleyre / Rebecca Piskorowski: Université Paris Cité, INSERM U1266, Institute of Psychiatry and Neuroscience of Paris, 75014 Paris, France
Laure Verret: Research Center on Animal Cognition, Center for Integrative Biology, Toulouse University, CNRS, UPS, 31062 Toulouse, France
English summary:
Social cognition is a key function for numerous species and is altered during several psychiatric and neurodegenerative diseases. While the hippocampus and in particular area CA2 are known to play a critical role in social memory formation, the underlying cellular mechanisms are not known.
In a recent study performed in mice, we describe how two synaptic plasticities of inhibitory transmission could be induced during the coding of a novel mouse and the formation of a lasting memory.
More precisely, we show how exposure to a novel mouse induces a long-term depression of inhibitory transmission form parvalbumin-expressing interneuron via activation of delta-opioid receptors. The resulting dis-inhibition allows principal cells in CA2 to fire action potentials and to evoke a second long-term depression of inhibition from cholecystokinin-expressing interneurons through activation of cannabinoid type I receptors (CB1). Blockade of CB1 receptors in area CA2 completely prevents social memory formation. Furthermore, CB1-mediated plasticity is strongly reduced in a mouse model of schizophrenia with impaired social memory. Finally, pharmacological manipulation known to improve social memory in these mice also restores CB1-mediated plasticity.
These results highlight how interaction between two inhibitory plasticities plays an important role in social memory formation and reveal new therapeutic targets for pathologies with social cognition impairments.
Figure Legend :
In basal condition, synaptic drive between CA3 and CA2 pyramidal neurons (PN) is dominated by a large feed-forward inhibition preventing CA2 PNs to fire action potentials (AP). When a mouse is exposed to a novel mouse, a long-term depression of inhibitory transmission from parvalbumin-expressing interneurons (PV-IN) is induced by activation of Delta-opioid receptors (DOR-iLTD). This disinhibition allows CA2 PNs to fire APs in response to CA3 inputs activation. Following subsequent exposure to the novel mouse, PNs that fire enough APs express a second iLTD mediated by activation of cannabinoid type I receptors (CB1R-iLTD), hence further increasing AP firing in these PNs.