Category: Uncategorized
Rencontre “French Neuroscience Showcase: Academia meets Industry”
En marge du congrès SfN à San Diego, Aviesan, le Consulat Général de France à Los Angeles et la Chambre…

Syndrome autistique : un nouveau gène responsable identifié
La délétion du gène TSHZ3 responsable d’un syndrome autistique Un consortium international, réunissant chercheurs et cliniciens autour des équipes de…
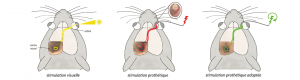
Rétines artificielles : de sérieuses pistes pour une vision plus nette
Formidable défi thérapeutique, les prothèses rétiniennes, développées depuis une dizaine d’années, permettent à certaines personnes aveugles de percevoir des signaux…

Alzheimer : importance des récepteurs de l’adénosine
Plasticité synaptique, mémoire et récepteurs de l’adénosine aux stades précoces de la maladie d’Alzheimer. Les troubles de la mémoire sont…

Fatigue cognitive et décisions économiques
Vous travaillez trop ? Vous dépensez plus ! Acheter le dernier smartphone ou économiser de l’argent pour partir aux Seychelles ? Résister…

Cajal Course: Hippocampus, from circuit to cognition
CAJAL Neuroscience Training Courses The Brain Prize course. Hippocampus: from Circuits to Cognition Over the past 50 years, major breakthroughs…
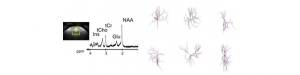
Caractériser la morphologie des neurones et des astrocytes in vivo par spectroscopie par résonance magnétique
Aborder la morphologie des cellules cérébrales, in vivo, de manière non-invasive reste un réel défi. Or, la morphologie des neurones…

Retour sur les Journées thématiques de la Société des Neurosciences
Escale au bord de la Loire… Les 24 et 25 mai derniers, plus de 200 participants ont assisté aux 2e…

Les lauréats du prix de thèse de la Société des Neurosciences
Les trois lauréats du prix de thèse de la Société des Neurosciences ont reçu leur prix lors des 2e Journées…
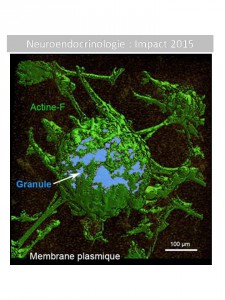
Un résumé des découvertes 2015 de la Neuroendocrinologie Française
La Neuroendocrinologie est une discipline transversale par excellence qui étudie les interactions réciproques entre le système nerveux et les systèmes…
