Uncategorized
Troubles de l’autisme: connexions défaillantes mise en cause
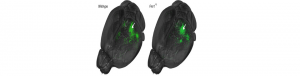
Des chercheurs du Neurocentre Magendie (Inserm/Université de Bordeaux) viennent de montrer comment les connexions altérées entre cellules du système nerveux étaient impliquées dans le syndrome de l’X fragile, responsable de troubles du spectre autistique. A l’aide de l’IRM, Andreas Frick, chargé de recherche Inserm, et son équipe ont en effet observé, sur une souris modèle de ce syndrome, une altération des connexions et de la communication entre différentes zones du cerveau. Ces nouvelles données sont susceptibles d’expliquer certains symptômes des troubles du spectre autistique, tels que l’hypersensibilité aux informations sensorielles ou les altérations de la perception visuelle.
Lire la suite :
Communiqué de presse de l’INSERM
Le détail de ces travaux est publié dans la revue Science Advances : Sci Adv. 2015 Nov 20;1(10):e1500775
Localisation ultrasonore ultrarapide (uULM) : Une révolution pour l’imagerie cérébrale

Les capillaires sanguins jouent un rôle majeur pour le fonctionnement du cerveau. L’équipe de Mickael Tanter (ESPCI/Inserm/CNRS) rapporte dans la revue Nature comment il est possible de les observer chez le rat avec une résolution temporelle hors du commun à l’échelle microscopique grâce à une nouvelle méthode utilisant les ultrasons ultrarapides. La microscopie par localisation ultrasonore ultrarapide (uULM) représente une avancée cruciale pour aider la communauté des Neurosciences à mieux appréhender comment le système vasculaire collabore au fonctionnement normal du système nerveux et possiblement comment ses dysfonctionnements pourraient intervenir dans les maladies neurologiques.
Référence :
Ultrafast ultrasound localization microscopy for deep super-resolution vascular imaging.
Errico C, Pierre J, Pezet S, Desailly Y, Lenkei Z, Couture O, Tanter M.
Nature. 2015 Nov 26;527(7579):499-502. doi: 10.1038/nature16066.
Lien communiqué de presse ESPCI
Source image : ESPCI/Inserm/CNRS
Syndrome de Gilles de la Tourette : Les tics sont-ils une mauvaise habitude ?

Les tics sont les manifestations principales du syndrome de Gilles de la Tourette. La cause de leur survenue et de leur persistance demeure en grande partie un mystère. Des chercheurs viennent de démontrer que les patients atteints d’un syndrome de Gilles de la Tourette forment davantage de comportements habituels que des sujets sains du même âge. Les tics pourraient ainsi être, au moins en partie, des actions apprises, qui se répètent à la manière de « mauvaises habitudes ». Ce travail est le fruit d’une collaboration entre des équipes de l’Institut du Cerveau et de la Moelle Epinière, de l’Ecole Normale Supérieure, de l’Université d’Amsterdam et de l’Université de Cambridge. L’article a été publié le 22 octobre dans la revue Brain.
Le syndrome de Gilles de la Tourette est caractérisé par l’association de tics moteurs et vocaux. Les tics sont des fragments de comportements finalisés, par exemple des clignements d’yeux,qui sont effectués de façon répétée et inappropriée. En ce sens, les tics ressemblent à des mauvaises habitudes : des comportements routiniers qui sont effectués de manière automatique dans certaines situations malgré des conséquences négatives pour le sujet, comme par exemple se ronger les ongles.
La dopamine est un neurotransmetteur impliqué dans les circuits de la récompense et qui favorise la formation de comportements habituels. Des réseaux neuronaux entre des régions sensorimotrices du cortex cérébral et des structures profondes du cerveau, les ganglions de la base, sont impliqués dans la genèse des habitudes. Des anomalies de ces mêmes structures, et une augmentation de la transmission dopaminergique ont été précédemment démontrées dans le syndrome de Gilles de la Tourette.
Dans l’étude, des patients atteints d’un syndrome de Gilles de la Tourette et des sujets sains ont été invités à réaliser un jeu informatique qui teste la formation des habitudes. Dans ce jeu, des images (stimuli) sont montrées successivement au sujet, qui doit apprendre au fil des essais sur quelle touche du clavier appuyer pour un stimulus donné. Cet apprentissage cherche à former chez le sujet une association entre chaque stimulus et la réponse qui lui est associée. Cet apprentissage est ensuite « dévalué » : on explique au sujet que certaines des réponses ne doivent plus être effectuées quand le stimulus associé est présenté. Des réponses qui persistent malgré la dévaluation sont considérées comme des réponses habituelles. Les résultats ont montré que les patients atteints d’un syndrome de Gilles de la Tourette font davantage de réponses habituelles que les sujets sains. Les patients traités par des médicaments inhibant la dopamine ont moins de réponses habituelles que les patients non traités. Une IRM cérébrale étudiant la connectivité entre différentes régions cérébrales a confirmé l’implication de réseaux neuronaux reliant le cortex moteur et les ganglions de la base dans la formation des habitudes chez les patients atteints d’un syndrome de Gilles de la Tourette.
Ces résultats nous éclairent sur les mécanismes à la base de la formation et de la persistance des tics, qui pourraient être en partie des comportements appris qui persistent de la même manière que des mauvaises habitudes.Des altérations des réseaux neuronaux connectant le cortex et les ganglions de la base, et une transmission dopaminergique accrue pourraient expliquer l’exacerbation de ces comportements habituels chez les patients avec un syndrome de Gilles de la Tourette. Ces résultats ont également des implications thérapeutiques intéressantes. En effet, les thérapies cognitivo-comportementales, qui sont un traitement reconnu dans le syndrome de Gilles de la Tourette, pourraient cibler spécifiquement cet apprentissage habituel anormal.
Référence :
Delorme C, Salvador A, Valabrègue R, Roze E, Palminteri S, Vidailhet M, et al.
Enhanced habit formation in Gilles de la Tourette syndrome.
Brain 2015: DOI: https://academic.oup.com/brain/article/139/2/605/1753685
Nouvelle cible pour la DMLA et la rétinopathie diabétique
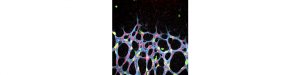
Les maladies vasoprolifératives oculaires sont les principales sources de cécité dans le monde et touchent des millions de personnes. Ainsi, une croissance anormale des vaisseaux sanguins est observée dans la dégénérescence maculaire liée à l’âge (DMLA exsudative), la rétinopathie diabétique et la rétinopathie de la prématurité.
Depuis plusieurs années, diverses protéines nécessaires au développement normal ou pathologique des vaisseaux ont été isolées, dont le facteur de croissance vasculaire endothélial (VEGF). L’injection intra-oculaire d’inhibiteurs du VEGF ou de ses récepteurs (Avastin, Lucentis…) est actuellement utilisée en clinique pour traiter la DMLA. Toutefois, certains patients ne répondent pas au traitement et d’autres y deviennent résistants. L’identification de nouveaux facteurs angiogéniques est donc primordiale à la mise au point d’approches thérapeutiques innovantes.
L’équipe dirigée par Alain Chédotal (Institut de la Vision, INSERM, CNRS, UPMC, Paris) en collaboration avec celle d’Anne Eichmann (Collège de France et Université de Yale) vient de découvrir qu’une protéine sécrétée, Slit2, et ses récepteurs, Robo1 et Robo2, favorisent la croissance vasculaire normale et pathologique en stimulant la migration des cellules endothéliales rétiniennes. Ce couple ligand/récepteur était déjà connu pour son rôle essentiel dans le développement des connexions neuronales.
L’utilisation de modèles murins a montré que l’inactivation de l’expression de Slit2 ou de Robo1/Robo2 inhibe le développement de la vascularisation rétinienne. De plus, l’inhibition de Slit2 permet de bloquer le développement de néo-vaisseaux dans un modèle de rétinopathie de la prématurité. L’étude a aussi montré que la fixation de Slit2 sur ses récepteurs induit la phosphorylation d’un récepteur au VEGF (VEGFR2) et l’activation de RAC1, une petit protéine G, révélant ainsi un lien inédit entre ces deux voies de signalisation. Ce travail suggère que des molécules ciblant le complexe Slit2/Robo pourraient permettre de bloquer la croissance anormale des vaisseaux, dans les pathologies oculaires mais aussi les cancers.
Référence:
Slit2 signaling through Robo1 and Robo2 is required for retinal neovascularization.
Rama N, Dubrac A, Mathivet T, Ní Chárthaigh RA, Genet G, Cristofaro B, Pibouin-Fragner L, Ma L, Eichmann A, Chédotal A.
Nature Medicine 2015 May;21(5):483-91. doi: 10.1038/nm.3849.
Source : communiqué de presse de l’INSERM
Se connecter au site de l’INSERM
Maladie d’Alzheimer: Un nouvel acteur moléculaire découvert par des équipes allemandes et une équipe française

Alzheimer : un nouvel acteur, passé inaperçu pendant 30 ans
Des chercheurs viennent d’identifier un nouveau peptide actif dans la maladie d’Alzheimer. Proche cousin du fameux amyloïde-β, qui s’accumule en formant des plaques dans les neurones des patients, il avait échappé à toute détection depuis trente ans. Pourtant, ce nouvel acteur, l’amyloïde-η (êta), est produit de façon constitutive dans le cerveau et perturbe les fonctions neuronales: une découverte qui pourrait avoir des conséquences sur certains essais cliniques en cours. Ces travaux sont le fruit d’une collaboration internationale entre des équipes allemandes1 et une équipe française de l’Institut de pharmacologie moléculaire et cellulaire (CNRS/Université Nice Sophia Antipolis). Ils sont publiés le 31 août 2015 par la revue Nature.
La maladie d’Alzheimer est associée à l’apparition d’agrégats neurotoxiques (plaques amyloïdes, accumulation de protéine tau) dans les neurones de l’hippocampe ; ces anomalies se propagent ensuite dans tout le cerveau. Il y a plus de trente ans, l’analyse chimique des plaques a révélé qu’elles sont composées de peptides amyloïde-β, eux-mêmes issus du découpage d’une protéine précurseur nommée APP. Alors que tous les efforts se concentraient sur l’amyloïde-β, une équipe internationale vient de découvrir que la protéine APP peut être découpée autrement, ce qui génère un peptide différent. Et ce nouveau peptide, nommé amyloïde-η (êta), n’est pas sans conséquences sur le fonctionnement des neurones.
Bien qu’il soit produit en plus grande quantité que l’amyloïde-β, l’amyloïde-η avait échappé à toute détection ces trente dernières années. En effet, les neuroscientifiques avaient concentré leur attention sur l’amyloïde-β, son mode de production et d’accumulation, sa toxicité pour les neurones et les moyens de l’inhiber pour traiter la maladie d’Alzheimer. Dans cette étude, après l’avoir identifié à la fois dans le cerveau de souris modèles pour la maladie et dans celui de patients, ils montrent que ce nouveau peptide, comme l’amyloïde-β, diminue le renforcement des synapses nécessaire à la mémorisation2. Par ailleurs, contrairement à l’amyloïde-β qui rend les neurones hyperactifs, l’amyloïde-η les rend plus difficilement excitables. Au vu de sa neurotoxicité, ce nouveau peptide est sans doute impliqué dans le mécanisme de la maladie d’Alzheimer, mais d’autres travaux seront nécessaires pour déterminer son impact sur les déficits cognitifs.
Cette découverte a néanmoins des conséquences immédiates sur les essais cliniques en cours, dont la plupart visent à réduire la quantité d’amyloïde-β dans l’espoir d’enrayer la perte de mémoire. Un de ces essais cliniques, par exemple, étudie l’inhibition de la β-sécrétase, une enzyme clé qui est impliquée dans la formation d’amyloïde-β. Or, les chercheurs viennent en effet de confirmer que l’inhibition de cette enzyme permet de réduire la production d’amyloïde-β mais que cela s’accompagne d’une augmentation massive d’amyloïde-η. Il est donc très probable que cette stratégie thérapeutique soit nocive pour le cerveau, par l’action exagérée d’amyloïde-η sur les neurones. Cette découverte invite les cliniciens à être très attentifs aux possibles effets secondaires non-anticipés des essais cliniques.
Des photos de l’équipe d’Hélène Marie sont disponibles sur demande.
Notes :
1 Des équipes de DZNE (Deutsches Zentrum für Neurodegenerative Erkrankungen), de Technische Universität München, et de Ludwig-Maximilians-Universität München.
2 Un type de plasticité appelé potentialisation à long terme (LTP en anglais).
Références :
η-Secretase processing of APP inhibits neuronal activity in the hippocampus, Michael Willem, Sabina Tahirovic, Marc Aurel Busche, Saak V. Ovsepian, Magda Chafai, Scherazad Kootar, Daniel Hornburg, Lewis D.B. Evans, Steven Moore, Anna Daria, Heike Hampel, Veronika Müller, Camilla Giudici, Brigitte Nuscher, Andrea Wenninger-Weinzierl, Elisabeth Kremmer, Michael T. Heneka, Dietmar R. Thal, Vilmantas Giedraitis, Lars Lannfelt, Ulrike Müller, Frederick J. Livesey, Felix Meissner, Jochen Herms, Arthur Konnerth, Hélène Marie & Christian Haass. Nature, Oct 15;526(7573):443-7.DOI:10.1038/nature14864
Contacts :
Chercheuse CNRS l Hélène Marie l T 04 93 95 34 40 l marie@ipmc.cnrs.fr
Presse CNRS l Véronique Étienne l T 01 44 96 51 37 l veronique.etienne@cnrs-dir.fr
Source : communiqué de presse du CNRS
Se connecter au site du CNRS
Photo : © copyright 2015 John Pusceddu (CNRS)
Stand Neuroscience in France – From Education to Research

La Société des Neurosciences, en partenariat avec l’ITMO Neurosciences, Sciences cognitives, Neurologie, Psychiatrie, l’INSERM, l’ENP et la mission scientifique de l’Ambassade de France, renouvelle l’organisation du stand “Neuroscience in France – From Education to Research” lors du congrès annuel des Neurosciences Américaines à Chicago.
Le stand vise à présenter l’organisation de la recherche française en neurosciences et les possibilités de financement les concernant. Il a également pour objectif de mieux faire connaître les différents sites et instituts de recherche français de Neurosciences.
Le numéro de stand est le 2154 :
https://www.sfn.org/annual-meeting/neuroscience-2015/exhibits/exhibit-hall
Nous vous y attendons nombreux !
Congrès Neuroscience 2015
17-21 octobre
McCormick Place Convention Center
2301 S. Lake Shore Drive
Chicago, IL 60616
Histoire de l’hypnose
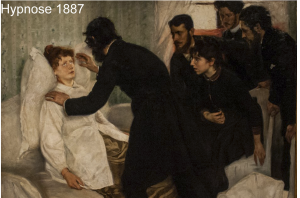
Histoire des Neurosciences : Histoire de l’hypnose
| PAR JEAN BECCHIO ET BRUNO SUAREZ
Historiquement, le concept d’hypnose apparaît en 1843 dans l’ouvrage Hypnology (1), sous la plume du médecin écossais, James Braid. Nous allons voir que l’hypnose existait bien avant Braid, sous d’autres formes, et qu’elle s’est développée de façon surprenante après la disparition de ce grand médecin, figure historique de ce mouvement.
La Préhistoire et le chamanisme
Nous vous proposons de revenir 17 500 années en arrière ; nous sommes en Dordogne, à Lascaux, et une représentation rupestre nous intéresse particulièrement, dans la salle nommée la « grotte du Sorcier ». Sur la paroi est dessiné un homme au visage couvert d’un masque d’oiseau.
Lire la suite …