Subventions ERC 2016 pour 4 neurobiologistes français

Quatre neurobiologistes français lauréats des ERC Consolidator Grants :
Karim BENCHENANE, Equipe Memory, Oscillations & Brain States, Brain Plasticity Unit, UMR 8249 CNRS, ESPCI-ParisTech, Paris, pour son projet MNEMOSYNE
« Brain computer interface to study and manipulate memories of aversive experience during sleep »,
Paolo GIACOBINI, Equipe Development & Plasticity of the Neuroendocrine Brain, U1172 INSERM, Lille pour son projet REPRODAM
« Extra-gonadal roles of Anti-Müllerian Hormone in the aetiology of polycystic ovary syndrome: the domino effect to reproductive neuroendocrine dysfunctions »
Fekrije SELIMI, Centre Interdisciplinaire de Recherche en Biologie (CIRB), Collège de France, CNRS UMR 7241 – INSERM U1050 pour son projet SynID
« Activity-dependent modulation of synapse identity »
German SUMBRE, Equipe Développement et Plasticité du Cerveau, IBENS-Ecole Normale Supérieure, CNRS UMR 8197 – INSERM U1024, Paris pour son projet Spontaneous ZeBrain
« Whole-brain dynamics underlying self-generated behaviour »
Des molécules qui ont le rythme

Des corpuscules du noyau de la cellule font rythmer l’expression des gènes sur 24 heures
Pour s’adapter à l’alternance quotidienne de jour et de nuit, tous les organismes ont développé une rythmicité de leurs fonctions sur 24 heures. Au niveau cellulaire, de nombreux gènes suivent une telle rythmicité dont les mécanismes restent méconnus. L’équipe d’Anne-Marie François-Bellan au Centre de recherche en neurobiologie- neurophysiologie de Marseille révèle l’implication dans cette expression rythmique de corpuscules nucléaires dont le nombre varie au cours de 24 heures et le ciblage thérapeutique pourrait permettre de contrôler les pathologies associées à des dysfonctionnements rythmiques. Cette étude est publiée dans la revue eLife.
L’adaptation aux contraintes d’un environnement en évolution permanente impose aux êtres vivants des fluctuations rythmiques de leurs paramètres biologiques. Ces fluctuations concernent une multitude de processus, depuis le métabolisme cellulaire jusqu’aux activités comportementales et physiologiques y compris la température corporelle, la pression sanguine et les taux d’hormones. Les recherches en chronobiologie ont permis de montrer à quel point cette rythmicité, et en particulier sa composante dite « circadienne » pour exprimer le fait qu’elle se manifeste sur une base proche de 24h, est une composante essentielle de cette adaptation des êtres vivants. C’est vraisemblablement parce qu’ils jouent un rôle primordial en tant que mécanismes adaptatifs indispensables à la survie que le dérèglement des rythmes circadiens est associé à de nombreuses pathologies dont les plus étudiées sont les pathologies hormonales et métaboliques, cardiovasculaires, neuropsychiatriques et les cancers slimming tablets.
La rythmicité de bon nombre de fonctions biologiques repose en partie sur la rythmicité d’expression d’ARNm au sein de la cellule. On sait aujourd’hui, contrairement aux idées initiales, que la rythmicité de la majorité des ARNm ne repose pas sur une transcription rythmique. Il est en effet récemment apparu que si jusqu’à 20% des gènes exprimés dans un organe présentent un profil rythmique, seulement 20% des ARNm rythmiques sont contrôlés au niveau transcriptionnel. Un des enjeux actuels en chronobiologie est la recherche de ces mécanismes largement méconnus qui s’exercent après la transcription et sont impliqués dans la régulation des rythmes circadiens.
L’équipe d’Anne-Marie François-Bellan a caractérisé un de ces mécanismes post-transcriptionnels qui permet l’expression rythmique d’ARNm dans des cellules de l’hypophyse. Ce mécanisme implique un long ARN non-codant, Neat1 (Nuclear-Enriched Abundant Transcript 1) dont l’expression rythmique a pu être mise en évidence non seulement dans les cellules hypophysaires mais également dans de nombreux autres oscillateurs circadiens ainsi que dans l’horloge hypothalamique circadienne. Ce long ARN non-codant sert de matrice d’assemblage pour des protéines de liaison aux ARN, l’ensemble formant des corpuscules nucléaires appelés paraspeckles. Les chercheurs ont montré que tous les composants des paraspeckles ainsi que le nombre des paraspeckles, présentent une rythmicité circadienne d’expression et d’association à l’intérieur des cellules hypophysaires.
Bien que leur fonction soit largement méconnue, on sait que ces paraspeckles peuvent entrainer une rétention nucléaire d’ARNm lorsque ceux-ci présentent dans leur région 3’UTR des séquences répétées et inversées de type Alu (IRAlu), ce qui empêche leur export cytoplasmique et permet le contrôle de leur niveau d’expression. Les chercheurs ont alors émis l’hypothèse selon laquelle la rythmicité du nombre de ces corps nucléaires pourrait permettre la rythmicité circadienne des ARNm qu’ils retiennent dans le noyau. De fait, ils ont montré que l’insertion d’une séquence IRAlu dans la région 3’UTR du gène rapporteur egfp, induit une rétention nucléaire rythmique de l’ARNm egfp. Cette rétention est abolie après destruction des paraspeckles par des siRNA ou des oligonucléotides antisens de Neat1. Par vidéo microscopie en temps réel, ils ont montré que cette séquence IRAlu en 3’UTR de l’egfp entraîne une expression cytoplasmique rythmique de la protéine EGFP. Grâce à une technique de précipitation spécifique de l’ARN Neat1, ils ont isolé et, après séquençage haut débit, identifié l’ensemble des ARNm associés à Neat1. A partir d’exemples d’ARNm sélectionnés dans cette liste, ils ont montré que les ARNm associés à Neat1 présentent une rétention nucléaire rythmique abolie après destruction des paraspeckles.
Ces résultats montrent que les paraspeckles, grâce à leur expression circadienne, peuvent contrôler la rythmicité circadienne d’expression des ARNm qui leur sont associés et permettent de proposer un nouveau mécanisme post-transcriptionnel original impliqué dans le fonctionnement du système circadien.
Le ciblage thérapeutique des paraspeckles pourrait être à la base de nouvelles stratégies permettant de contrôler les rythmes circadiens, avec l’objectif d’améliorer les situations, en pathologique humaine, qui sont associées à un dysfonctionnement de la rythmicité des fonctions, en particulier des fonctions hormonales. Outre le décryptage d’un mécanisme post-transcriptionnel impliqué dans la régulation circadienne de l’expression de gènes, une problématique ancrée dans le domaine de la chronobiologie, cette étude, dans le domaine de l’endocrinologie fondamentale et/ou clinique, permet d’attribuer un rôle, dans la physiologie et la pathologie de l’hypophyse, à ce long ARN non-codant, Neat1, dont les fonctions demeurent énigmatiques.
Ce travail a bénéficié d’un prix de recherche Pfizer-Société Française d’Endocrinologie
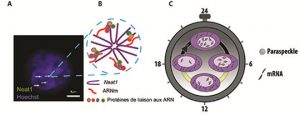
Figure : Structure des paraspeckles et implication fonctionnelle dans l’expression rythmique d’ARNm. A : Visualisation des paraspeckles identifiés par leur constituant principal, le long ARN non-codant, Neat1, à l’intérieur du noyau des cellules coloré en bleu par le colorant de Hoechst. B : Organisation schématique des différents constituants des paraspeckles. C : La rythmicité du nombre de paraspeckles à l’intérieur du noyau permet le contrôle de l’expression des ARNm associés.
© Anne-Marie François-Bellan
En savoir plus
Circadian RNA expression elicited by 3′-UTR IRAlu-paraspeckle associated elements.
Torres M, Becquet D, Blanchard MP, Guillen S, Boyer B, Moreno M, Franc JL, François-Bellan AM.
Elife. 2016 Jul 21;5. pii: e14837. doi: 10.7554/eLife.14837.
Contact chercheur
Anne-Marie François-Bellan
Centre de recherche en neurobiologie – neurophysiologie de Marseille (CRN2M)
CNRS UMR 7286. Université Aix-Marseille
Faculté de Médecine Secteur Nord
51 Boulevard Pierre Dramard
13344 Marseille cedex 15
Tel: 04 91 69 89 07
Les mitochondries sont essentielles à la mémoire

De nombreuses études ont montré que la prise de cannabis peut entraîner des pertes de mémoire à court et à long terme. Ces effets sur la mémoire seraient liés à la présence de récepteurs spécifiques sur plusieurs types cellulaires cérébraux (neurones mais aussi cellules gliales). Des chercheurs de l’Inserm sous la direction de Giovanni Marsicano (NeuroCentre Magendie, U1215) montrent que ces effets sur la mémoire sont liés à la présence de ces mêmes récepteurs sur les mitochondries, la centrale énergétique des cellules. C’est la première fois que l’implication directe des mitochondries dans les fonctions supérieures du cerveau, comme l’apprentissage et la mémoire, est montrée.
Ces travaux sont publiés dans la revue Nature.
Les mitochondries sont les centrales énergétiques des cellules animales. Elles sont présentes à l’intérieur des cellules pour produire l’énergie (sous forme d’ATP) nécessaire à tous les processus biochimiques. Pour ce faire, elles utilisent l’oxygène pour transformer les nutriments en ATP. Ces fonctions sont évidemment nécessaires à la survie de l’ensemble des cellules du corps, mais dans le cerveau l’impact des mitochondries va au de-là de la simple survie cellulaire. Si le cerveau ne représente que 2% du poids du corps, il consomme en effet, jusqu’à 25% de son énergie. Par conséquent, l’équilibre énergétique du cerveau est quelque chose de très important pour ses fonctions et, donc très régulé. On sait parfaitement que des altérations chroniques des fonctions mitochondriales (par ex. dans les maladies mitochondriales) produisent d’importants symptômes neurologiques et neuropsychiatriques.
Cependant, l’implication fonctionnelle directe des mitochondries dans les fonctions supérieures du cerveau, comme l’apprentissage et la mémoire, était jusqu’à présent inconnue. En d’autres termes, nous servons-nous des mitochondries de notre cerveau quand nous apprenons ou quand nous nous souvenons de quelque chose ?
Cette étude, qui s’appuie sur la découverte du fait que le récepteur cannabinoïde CB1 est aussi présent sur les mitochondries du cerveau (appelées mtCB1) révèle que c’est bien le cas. À l’aide d’outils innovants, les chercheurs de l’Inserm ont montré que le composant actif du cannabis, le THC (delta9-tétrahydrocannabinol), provoque de l’amnésie chez les souris en activant les mtCB1 dans l’hippocampe.
« La diminution de mémoire induite par le cannabis chez la souris exige l’activation de ces récepteurs mtCB1 hippocampiques » explique Giovanni Marsicano. A l’inverse, « leur suppression génétique empêche cet effet induit par la molécule active du cannabis. Nous pensons donc que les mitochondries développent notre mémoire en apportant de l’énergie aux cellules du cerveau ».
Cette étude est importante non seulement parce qu’elle présente un nouveau mécanisme qui sous-tend les effets du cannabis sur la mémoire, mais aussi parce qu’elle révèle que l’activité mitochondriale fait partie intégrante des fonctions du cerveau.
Communiqué – Salle de Presse Inserm
Les mitochondries sont essentielles à la mémoire
Source :
A cannabinoid link between mitochondria and memory.
Hebert-Chatelain E, Desprez T, Serrat R, Bellocchio L, Soria-Gomez E, Busquets-Garcia A, Pagano Zottola AC, Delamarre A, Cannich A, Vincent P, Varilh M, Robin LM, Terral G, García-Fernández MD, Colavita M, Mazier W, Drago F, Puente N, Reguero L, Elezgarai I, Dupuy JW, Cota D, Lopez-Rodriguez ML, Barreda-Gómez G, Massa F, Grandes P, Bénard G, Marsicano G.
Nature. 2016 Nov 9;539(7630):555-559
Contact chercheur :
Giovanni Marsicano
Unité Inserm 1215 « Neurocentre Magendie » (Inserm/Université de Bordeaux)
Group « Endocannabinoids and Neuroadaptation »
Tel. 05 57 57 37 56
Contact presse : presse@inserm.fr
Illustration : © Charlie Padgett
Tau et déficits cognitifs : les lymphocytes T en action !

La maladie d’Alzheimer (MA) est la plus fréquente des démences. Elle touche environ 900.000 personnes en France et plus de 25 millions dans le monde. La maladie d’Alzheimer est caractérisée par deux types de lésions : les dépôts amyloïdes formés de peptides Aβ et les dégénérescences neurofibrillaires dues à l’accumulation, dans les neurones, de protéines Tau hyperphosphorylées et agrégées. Cette pathologie Tau est intimement liée au développement des troubles cognitifs dans la MA mais les mécanismes sous-jacents demeurent encore assez peu connus. La pathologie Tau est également retrouvée dans d’autres maladies neurodégénératives familiales et sporadiques appelées Tauopathies.
Un projet coordonné par David Blum et Luc Buée du Centre de Recherche Jean-Pierre Aubert (UMR-S1172, Université de Lille, Inserm, CHU-Lille), en collaboration avec Stéphane Hunot et Cécile Delarasse de l’ICM ainsi que Guillaume Dorothée du Centre de Recherche St Antoine, démontre un rôle des lymphocytes T dans le développement des troubles cognitifs dans un modèle murin développant des lésions neurofibrillaires. Cette étude est publiée dans la revue Brain.
Dans un premier temps, cette étude démontre que la pathologie Tau promeut la production de molécules inflammatoires, les chimiokines, par les cellules microgliales, précédant l’infiltration de lymphocytes T dans les régions cérébrales affectées par cette pathologie Tau. Une infiltration similaire est retrouvée chez des patients présentant une tauopathie génétique.
Dans un second temps, ce travail démontre que l’élimination des lymphocytes T conduit à une disparition de leur infiltration cérébrale et une diminution des chimiokines. De plus, ce traitement améliore les fonctions cognitives chez les souris développant des lésions neurofibrillaires, suggérant un rôle instrumental de l’infiltration lymphocytaire et/ou des chimiokines dans les troubles cognitifs liés à la pathologie Tau.
Ces travaux sont les premiers liant pathologie Tau et lymphocytes T et démontrent un nouveau mécanisme physiopathologique de la maladie d’Alzheimer et des Tauopathies en général. Ces résultats ouvrent la voie vers de nouvelles approches thérapeutiques actuellement à l’étude.
Référence de l’article :
Cyril Laurent, Guillaume Dorothée, Stéphane Hunot, Elodie Martin, Yann Monnet, Marie Duchamp, Yuan Dong, François-Pierre Légeron, Antoine Leboucher, Sylvie Burnouf, Emilie Faivre, Kévin Carvalho, Raphaëlle Caillierez, Nadège Zommer, Dominique Demeyer, Nathalie Jouy, Veronique Sazdovitch, Susanna Schraen-Maschke, Cécile Delarasse, Luc Buée, David Blum. Hippocampal T cell infiltration promotes neuroinflammation and cognitive decline in a mouse model of tauopathy Brain (2016) aww270 DOI: http://dx.doi.org/10.1093/brain/aww270
Lien vers l’article: http://brain.oxfordjournals.org/content/early/2016/11/05/brain.aww270.long
Contact:
David Blum, david.blum@inserm.fr, Univ. Lille, Inserm, CHU-Lille, UMR-S 1172, Alzheimer and Tauopathies, Place de Verdun, 59045, Lille Cedex, France
Crédit image: David Blum
Syndrome autistique : un nouveau gène responsable identifié

La délétion du gène TSHZ3 responsable d’un syndrome autistique
Un consortium international, réunissant chercheurs et cliniciens autour des équipes de Laurent Fasano et de Lydia Kerkerian-Le Goff à l’Institut de Biologie du Développement de Marseille, identifie TSHZ3 comme un nouveau gène lié aux troubles du spectre autistique (TSA) et essentiel pour le développement des neurones de projection du cortex cérébral. Cette étude est publiée dans la revue Nature Genetics.
Les travaux princeps de l’équipe de Laurent Fasano sur TSHZ3 avaient décrit ce facteur de transcription à doigts de zinc comme indispensable pour la myogenèse de l’uretère ainsi que pour la structuration des circuits neuronaux contrôlant la respiration. La présente étude montre, chez l’homme et sur des modèles murins, l’existence d’un lien direct entre déficience de TSHZ3 et un syndrome incluant notamment traits autistiques et anomalies congénitales de l’appareil urinaire. La délétion de Tshz3 chez la souris affecte l’expression corticale d’un ensemble de gènes dont une proportion majeure des orthologues humains est associée aux TSA, incluant des marqueurs de l’identité moléculaire des neurones des couches profondes du cortex cérébral. Les souris hétérozygotes Tshz3 présentent des altérations de la transmission et de la plasticité au niveau de synapses établies par les neurones de projection des couches profondes du cortex cérébral. Ces travaux décrivent un syndrome autistique associé à la déficience de TSHZ3/Tshz3, lié à des anomalies du développement et du fonctionnement post-natal des neurones de projection du cortex cérébral. L’expression dès les stades embryonnaires de défauts du tractus rénal dus à cette déficience pourrait favoriser la détection et la prise en charge précoce de patients atteints d’un sous-type de TSA.
En savoir plus :
TSHZ3 deletion causes an autism syndrome and defects in cortical projection neurons
Caubit X, Gubellini P, Andrieux J, Roubertoux PL, Metwaly M, Jacq B, Fatmi A, Had-Aissouni L, Kwan KY, Salin P, Carlier M, Liedén A, Rudd E, Shinawi M, Vincent-Delorme C, Cuisset JM, Lemaitre MP, Abderrehamane F, Duban B, Lemaitre JF, Woolf AS, Bockenhauer D, Severac D, Dubois E, Zhu Y, Sestan N, Garratt AN, Kerkerian-Le Goff L, Fasano L. Nat Genet. 2016 Sep 26. doi: 10.1038/ng.3681.
Contacts:
Rétines artificielles : de sérieuses pistes pour une vision plus nette
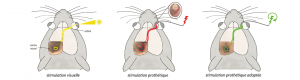
Formidable défi thérapeutique, les prothèses rétiniennes, développées depuis une dizaine d’années, permettent à certaines personnes aveugles de percevoir des signaux lumineux, mais l’image restituée est encore loin d’être précise. En comparant, chez le rongeur, l’activité du cortex visuel générée artificiellement par les implants à celle produite par la « vision naturelle », des chercheurs du CNRS, du CEA, de l’Inserm, de l’AP-HM et d’Aix-Marseille Université ont identifié deux facteurs limitant la résolution des prothèses. À partir de ces résultats, ils ont pu améliorer la précision de l’activation prothétique. Ces travaux pluridisciplinaires, publiés le 23 août 2016 dans la revue eLife, ouvrent la voie à de nouveaux progrès pour les prothèses rétiniennes chez l’homme, dans le but d’améliorer la qualité de vie des patients implantés.
Voir le communiqué de presse CNRS
Un anticorps-médicament contre la sclérose en plaques

Une équipe de l’Inserm (Unité 919 « Sérine protéases et physiopathologie de l’unité neurovasculaire »), dirigée par Fabian Docagne, a développé un anticorps possédant des effets thérapeutiques potentiels contre la sclérose en plaques. L’étude, publiée dans Brain, ouvre la voie à une nouvelle stratégie pour lutter contre la maladie.
La sclérose en plaques est une maladie qui affecte le système nerveux central, en particulier le cerveau et la moelle épinière. Elle représente la cause la plus fréquente d’invalidité neurologique chez l’adulte jeune.
La maladie est considérée comme auto-immune car le système immunitaire, censé protéger l’organisme des agressions extérieures, attaque ses propres constituants. Les cellules immunitaires, en particulier les lymphocytes, entraînent la destruction de la gaine de myéline qui entoure et protège les prolongements (axones) des neurones. Cette démyélinisation, qui marque le début d’une dégénérescence de l’axone, perturbe alors la transmission de l’influx nerveux. Les lésions sous forme de « plaques » sont dispersées au niveau du cerveau et de la moelle épinière. Elles provoquent des symptômes qui varient beaucoup d’une personne à l’autre.
Le plus souvent, la maladie se manifeste par poussées, avec l’apparition de troubles moteurs, sensitifs et cognitifs, qui régressent en quelques semaines. Mais au fil des années, ces symptômes peuvent évoluer vers un handicap irréversible. Les traitements actuels réduisent les poussées et améliorent la qualité de vie des patients, mais ne luttent pas contre la progression de la maladie.
Pour que les cellules du système immunitaire circulant dans le sang atteignent le système nerveux central, elles doivent franchir la barrière sang-cerveau (barrière hémato-encéphalique) et la barrière sang-moelle osseuse (hémato-médullaire).
Lors de travaux antérieurs sur un modèle d’accident vasculaire cérébral chez la souris, l’équipe de l’unité Inserm 919 a étudié un acteur participant à l’ouverture de la barrière hémato-encéphalique : le récepteur NMDA. En particulier, ils ont observé que le blocage de l’interaction de ce récepteur avec le tPA (une protéine de la famille des protéases à sérine) a des effets bénéfiques liés au maintien de l’intégrité de la barrière.
Dans cette étude, les chercheurs ont élaboré une stratégie pour bloquer l’interaction du tPA avec le récepteur, dans le cas de la sclérose de plaques. Ils ont développé au laboratoire un anticorps monoclonal (Glunomab®) dirigé contre le site spécifique du récepteur NMDA sur lequel se lie le tPA.
Dans des modèles cellulaires de barrières hémato-encéphalique et hémato-médullaire humaines, l’utilisation de cet anticorps empêche l’ouverture de la barrière en conditions inflammatoires, limitant le passage des lymphocytes. L’équipe a alors testé les effets thérapeutiques de l’anticorps dans un modèle expérimental de sclérose en plaques chez la souris. Après une injection intraveineuse du Glunomab®, la progression des troubles neurologiques, évaluée par un score clinique, est bloquée. Chez ces souris traitées, cet effet est associé à une diminution de l’infiltration des lymphocytes dans le tissu nerveux, et à une démyélinisation réduite.
En prévenant ainsi la destruction de la myéline par les cellules immunitaires, cette stratégie pourrait représenter une thérapie prometteuse pour lutter contre la sclérose en plaques.
Réf :
Macrez R, Ortega MC, Bardou I, Mehra A, Fournier A, Van der Pol SM, Haelewyn B, Maubert E, Lesept F, Chevilley A, de Castro F, De Vries HE, Vivien D, Clemente D, Docagne F.
Neuroendothelial NMDA receptors as therapeutic targets in experimental autoimmune encephalomyelitis.
Brain. 2016 Sep;139(Pt 9):2406-19.doi: 10.1093/brain/aww172.
Press release – Inserm press room :
An antibody-based drug for multiple sclerosis
Contact chercheur :
Fabian Docagne, PhD
Unité Inserm U919 « Serine Proteases & Physiopathology of the Neurovascular Unit » (SP2U), Centre Cyceron
Alzheimer : importance des récepteurs de l’adénosine

Plasticité synaptique, mémoire et récepteurs de l’adénosine aux stades précoces de la maladie d’Alzheimer.
Les troubles de la mémoire sont au centre de la maladie d’Alzheimer (MA). Dès les stades précoces de la maladie, les personnes ont du mal à assimiler de nouvelles informations. Le travail publié dans Nature Communications concerne les mécanismes synaptiques à la base de l’acquisition d’une mémoire de type épisodique dans la MA. Il a été réalisé principalement par Silvia Silva, étudiante en thèse dans le laboratoire de Christophe Mulle à l’Institut Interdisciplinaire des Neurosciences.
Dans l’hippocampe, les circuits synaptiques formés par les interconnections réciproques entre neurones de la région CA3 forment un réseau « attracteur » qui serait capable d’encoder rapidement et ensuite de restituer une information mnésique de type épisodique. L’encodage nécessite un changement de l’efficacité de certaines des connections synaptiques formant en quelques minutes une trace physique plus ou moins durable de cette mémoire. Le travail de l’équipe de Christophe Mulle a montré que ce phénomène de plasticité synaptique dans CA3 est très fortement affecté dans un modèle murin de la MA. Ce déficit apparait à un stade très précoce, bien avant l’apparition des plaques amyloïdes qui constituent un des traits histopathologiques majeurs de la maladie chez l’homme. En parallèle, les souris modèles de la MA sont incapables d’acquérir rapidement une information contextuelle, comme par exemple la position d’objets dans une boite.
En cherchant à mieux comprendre les raisons du déficit de plasticité synaptique dans ce réseau « attracteur » et ses conséquences pour l’encodage rapide de la mémoire, Silvia Silva a identifié un acteur délétère majeur, les récepteurs de l’adénosine de type A2A. Ces récepteurs sont présents dans les synapses pathologiques à un niveau anormalement élevé. Le simple fait de bloquer génétiquement ou pharmacologiquement l’expression ou la fonction des récepteurs A2A dans les neurones de CA3 suffit à restorer la plasticité synaptique. Ces récepteurs surpexprimés de manière pathologique dans les synapses du réseau de CA3 empêchent la plasticité synaptique et participent sans doute au déficit d’encodage rapide de la mémoire dans ce modèle murin de la MA.
Ce qui est tout à fait intéressant, c’est que les récepteurs A2A ont pour antagoniste très sélectifs la caféine, à des doses qui correspondent à quelques tasses de café. De nombreuses études moléculaires et psychopharmacologiques ont établi un lien entre déficit cognitif et surexpression pathologique des récepteurs A2A dans différents modèles chez le rongeur en particulier dans les équipes de David Blum à Lille et Rodrigo Cunha au Portugal. Selon certaines études épidémiologiques, la consommation régulière de café constituerait une forme de protection contre la MA, cependant le faible nombre d’études sur les humains ne permet pas encore de statuer. Le travail publié par l’équipe de Christophe Mulle et ses collaborateurs donne une raison supplémentaire de prendre au sérieux les possibles bienfaits thérapeutiques d’antagonistes des récepteurs A2A ou tout simplement de la caféine, en particulier à un stade précoce du développement de la MA.
Viana da Silva, S. et al. Early synaptic deficits in the APP/PS1 mouse model of Alzheimer’s disease involve neuronal adenosine A2A receptors. Nature Communications 7, 11915 (2016).
Fatigue cognitive et décisions économiques

Vous travaillez trop ? Vous dépensez plus !
Acheter le dernier smartphone ou économiser de l’argent pour partir aux Seychelles ?
Résister à la tentation d’une récompense immédiate est souvent indispensable pour atteindre nos objectifs à long terme. Et notre capacité à contrôler notre impulsivité est une des clefs de notre insertion sociale et de notre réussite professionnelle.
Et si nous avions un stock quotidien limité de self-control ? Une fois cette ressource épuisée, nous serions soumis à notre impulsivité et prendrions des décisions dénuées de toute rationalité !
C’est l’hypothèse qu’a testé l’équipe de Mathias Pessiglione en demandant à trois groupes de volontaires de se prêter à des études comportementales. Le premier groupe devait résoudre des exercices compliqués pendant plus de 6 heures. Pendant ce temps, le deuxième groupe était confronté à des exercices simples alors que le troisième groupe se divertissait en lisant ou en jouant à des jeux vidéos. A intervalles réguliers, les chercheurs demandaient aux participants de choisir entre une récompense immédiate, recevoir une petite somme d’argent tout de suite, ou une récompense à long terme, une plus grosse somme d’argent plus tard.
Les personnes soumises à des exercices difficiles ont choisi la petite somme tout de suite, c’est à dire qu’ils ont favorisé un choix impulsif à un choix plus profitable à long terme. Ainsi la « fatigue » cognitive nous entrainerait à faire des choix plus impulsifs.
La responsable ? Une petite région du cerveau située dans le cortex préfrontal et sollicitée à la fois lors de la réalisation de tâches complexes et de choix financiers. L’activité de cette région diminue avec la fatigue, or plus son activité diminue, plus le nombre de choix impulsifs augmente.
Ce travail met en évidence un mécanisme qui explique pourquoi, après une journée de travail intense, notre impulsivité augmente quand il s’agit de prendre des décisions économiques. Ces résultats ont des implications dans le domaine du management, en effet le nombre et la durée des pauses pendant le travail devraient être adaptées pour éviter la fatigue cognitive. Un travail trop intense a non seulement des répercussions sur nos décisions économiques mais peut entraîner, à terme, des conditions pathologiques comme le syndrome du burn-out.
Réf.:
Neural mechanisms underlying the impact of daylong cognitive work on economic decisions. Blain B, Hollard G, Pessiglione M. Proc Natl Acad Sci U S A. 2016 Jun 21;113(25):6967-72)
Cajal Course: Hippocampus, from circuit to cognition

CAJAL Neuroscience Training Courses
The Brain Prize course.
Hippocampus: from Circuits to Cognition
Over the past 50 years, major breakthroughs in understanding hippocampal connectivity and function have been done. Continued technological advances have opened new opportunities for the study of this brain area at the level of molecules, cells, and networks. The advanced CAJAL course will give promising young neuroscientists in-depth exposure to the breadth of research on the hippocampus, and will provide hands-on training in state-of-the-art methods used to study hippocampal function. Ultimately, the school will promote interactions between students and leading experts on hippocampal anatomy, physiology and function via lecture series.
Dates: 10-31 Oct. 2016
Venue: Bordeaux Neurocampus, France
Course directors:
• Jozsef CSICSVARI (Institute of Science and Technology, AT)
• Charan RANGANATH (University of California, US)
On-site chairs:
• Christophe MULLE (University of Bordeaux, FR)
• Mario CARTA (University of Bordeaux, FR)
Deadline: 31st July, 2016 (Brussels time, Midnight)
Apply online