Uncategorized
Une avancée majeure pour la compréhension des ataxies cérébelleuses
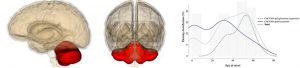
Des chercheurs de l’Institut du Cerveau et de la Moëlle Epinière (ICM) à l’Hôpital de la Pitié-Salpetrière à Paris viennent de publier une large étude de génétique épidémiologique portant sur 412 patients atteints d’ataxie cérébelleuse autosomique dominante.
L’hétérogénéité génétique de ces maladies, qui touchent le cervelet et affecte la coordination et l’équilibre et peuvent être causées par des mutations dans plus de 40 gènes, rend leur diagnostic génétique compliqué. Le plus fréquemment, la mutation incriminée est une expansion d’une répétition d’une courte séquence de nucléotides, telle qu’un triplet « CAG ». Dans de plus rares cas, on est en présence de mutations plus « conventionnelles ». Si l’épidémiologie des formes dites à expansion a été bien étudiée, ce n’est pas le cas de ces dernières.
Les chercheurs ont conçu un panel permettant de séquencer en une fois l’ensemble des 34 gènes connus pour présenter ce type de mutations dans les ataxies cérébelleuses, et l’ont utilisé chez 412 patients qui ne présentaient pas d’expansion de répétition. Cela leur a permis d’identifier une mutation responsable chez près de 15% des patients auparavant non diagnostiqués. Les gènes codant pour des canaux ioniques étaient les plus fréquemment mutés, ce qui confirme leur importance majeure dans le fonctionnement du cervelet.
Ils ont aussi comparé les présentations cliniques de l’ataxie cérébelleuse entre des patients porteurs d’une expansion et des patients présentant une mutation conventionnelle. Ces derniers commencent souvent la maladie plus tôt, mais montrent une progression plus lente et un phénotype plus pur, avec moins d’autres signes accompagnateurs.
Cette étude, en plus d’apporter un diagnostic précis à une proportion non négligeable de patients, permet donc de mieux caractériser les aspects génétiques et cliniques des ataxies cérébelleuses autosomiques dominantes, ce qui améliorera la prise en charge et le conseil génétique pour les patients.
Référence de l’article:
A panel study on patients with dominant cerebellar ataxia highlights the frequency of channelopathies.
Coutelier M, Coarelli G, Monin ML, Konop J, Davoine CS, Tesson C, Valter R, Anheim M, Behin A, Castelnovo G, Charles P, David A, Ewenczyk C, Fradin M, Goizet C, Hannequin D, Labauge P, Riant F, Sarda P, Sznajer Y, Tison F, Ullmann U, Van Maldergem L, Mochel F, Brice A, Stevanin G, Durr A; SPATAX network. Brain. 2017 Jun 1;140(6):1579-1594. doi: 10.1093/brain/awx081.
Lien vers l’article: https://academic.oup.com/brain/article-lookup/doi/10.1093/brain/awx081
Contact:
Dr Alexandra Durr
Reference centre for Rare diseases-Neurogenetics
ICM (Institut du Cerveau et de la Moelle épinière)
Salpêtrière Hospital – Université Pierre et Marie Curie
47 boulevard de l’Hôpital
75651 Paris CEDEX 13
alexandra.durr@icm-institute.org
Marches pour les Sciences

Le 22 avril, auront lieu dans le monde entier, des “Marches pour les sciences”.
La Société des Neurosciences, comme la FENS et de nombreuses sociétés scientifiques internationales, s’associe à cette action qui a pour objectif de mettre en avant l’importance pour le bien commun et la civilisation de la démarche scientifique, respectant les faits et l’honnêteté intellectuelle, ouverte à tous dans le monde entier.
Pour plus d’information sur les actions en France :
un anxiolytique naturellement efficace !

Des chercheurs de l’Institut des maladies neurodégénératives de Bordeaux (IMN-UMR-CNRS 5293 / Université de Bordeaux) viennent de découvrir que les réactions anxieuses occasionnées par des facteurs de stress pourraient être le reflet des changements synaptiques qui s’opèrent dans une petite région du cerveau : Le noyau du lit de la strie terminale (BNST). A travers des expériences conduites chez des rats exposés à des situations anxiogènes, les chercheurs ont disséqué un circuit neuronal qui, lorsqu’il est activé, réduit les niveaux d’anxiété de l’animal pendant plusieurs jours. Ces résultats, issus d’une collaboration entre deux laboratoires bordelais (IMN-UMR-CNRS 5293 et INCIA-UMR-CNRS 5287) et un laboratoire suisse (FMI, Basel, Switzerland) sont publiés dans Nature Communications, le 20 Février 2017.
L’anxiété est une émotion physiologique qui déclenche un état d’alerte en réponse à une menace réelle ou supposée et constitue ainsi un mécanisme de survie. Le noyau du lit de la stria terminalis (BNST) appartient à un réseau neuronal de régions limbiques interconnectées et exerce un rôle central dans l’expression de l’anxiété chez de nombreuses espèces animales, et notamment chez l’Homme. Les auteurs de l’étude ont utilisé des approches virales pour tracer les voies neuronales dans trois régions cérébrales impliquées dans les comportements associés à l’état d’anxiété. Ils ont enregistré et manipulé, in vivo, l’activité électrique des neurones. Ils ont ainsi mis en évidence qu’une population de neurones du BNST (centre cérébral de la motivation et de l’anxiété), intégrait et filtrait des informations en provenance du subiculum ventral (centre cérébral de la mémoire des émotions) et du cortex infralimbique (centre cérébral de la mémoire et des habitudes) pour augmenter de façon persistante leur activité. Les conséquences de ce changement d’état des neurones du BNST sont, en particulier des changements d’état anxieux de l’animal.
Les chercheurs ont ainsi pu déterminer que la mise en place d’une plasticité de type potentialisation à long terme au niveau des synapses « subiculum ventral/BNST » provoque un effet activateur et persistant (plusieurs jours) sur les neurones du BNST ayant pour conséquence de jouer le rôle d’un anxiolytique.
Ce travail, en précisant les circuits neuronaux et mécanismes de plasticité synaptique qui réduisent les niveaux d’anxiété de l’animal de manière persistante, ouvre de nouvelles perspectives pour comprendre comment un changement de l’état synaptique des neurones du BNST pourrait modifier la perception de stimuli sensoriels en condition pathologique (addiction, trouble de l’anxiété). Ces travaux ont été financés notamment par l’Agence nationale pour la recherche (ANR), le CNRS et l’université de Bordeaux.
Référence:
NMDA-receptor-dependent plasticity in the bed nucleus of the stria terminalis triggers long-term anxiolysis.Glangetas C, Massi L, Fois GR, Jalabert M, Girard D, Diana M, Yonehara K, Roska B, Xu C, Lüthi A, Caille S, Georges F. Nat Commun. 2017 Feb 20;8:14456.
Contact auteur : Dr François GEORGES, CNRS/Université de Bordeaux : francois.georges@u-bordeaux.fr / Tel : +33 5 33 51 48 13
Hightlights NeuroFrance 2017

NeuroFrance 2017, un programme plus dense, plus riche :
7 conférenciers pléniers de renommée internationale, 42 symposiums, des symposiums spécialisés, des sessions “Réussir avec une thèse en neurosciences”, lectures de CV et courts entretiens, près de 600 posters
Une exposition commerciale de plus de 45 stands
NeuroNight : pour une soirée mémorable en bord de Garonne !
Ne ratez pas l’occasion de participer et de découvrir Bordeaux, numéro 1 des villes à visiter en 2017 selon le Lonely Planet !
Inscrivez-vous avant le 5 avril pour bénéficier des tarifs préférentiels !
Faits marquants 2016

Pour élaborer ces “faits marquants 2016”, les membres du Conseil d’Administration de la Société des Neurosciences ont sélectionné quelques publications parmi les plus remarquables dans leur discipline. Les magnifiques découvertes présentées ici témoignent de la vitalité des Neurosciences françaises, et de la réalité de l’avancement des connaissances dans toutes les branches des Neurosciences, grâce aux chercheurs en France. Bien d’autres articles auraient mérité d’être dans cet échantillon !

Consultez les faits marquants 2016
La huntingtine, une protéine essentielle à l’assemblage du cortex cérébral

Le cortex des mammifères est formé de six couches de neurones dont l’assemblage est précisément régulé au cours du développement. Les neurones excitateurs corticaux (également appelés neurones de projection) sont produits dans la zone ventriculaire, subissent ensuite une transition multipolaire-bipolaire, une migration radiale et une différenciation. Nous montrons dans cette étude que la huntingtine (HTT), protéine mutée dans la maladie de Huntington (MH), est nécessaire pour la transition multipolaire-bipolaire des neurones de projection et pour le maintien de leur forme bipolaire lors de leur migration radiale. La HTT est responsable de ces effets in vivo en agissant sur le trafic de la N-Cadhérine qui dépend de la petite protéine GTPase RAB11. Lorsque la HTT contient la mutation responsable de la MH ces mécanismes sont altérés. Enfin, nous montrons que les défauts corticaux résultant de la perte post mitotique de la HTT spécifiquement pendant le développement embryonnaire affectent la morphologie neuronale à l’âge adulte.
Ces travaux sont importants pour plusieurs raisons. Alors que la MH est une maladie neurologique héréditaire se manifestant à l’âge adulte, il y a de plus en plus d’évidences qu’un développement anormal contribuerait aux symptômes observés à l’âge adulte. Nos travaux vont dans ce sens en établissant une nouvelle fonction de la HTT au cours du développement cortical, fonction qui est altérée dans la MH. De façon plus générale, notre étude souligne précisément comment la transition multipolaire-bipolaire des neurones de projections qui a lieu pendant la période embryonnaire influence la position des neurones mais également leur morphologie.
Référence de l’article: Barnat M, Le Friec J, Benstaali C, Humbert S. Huntingtin-mediated Multipolar-Bipolar Transition of Newborn Cortical Neurons is Critical for their Postnatal Neuronal Morphology, Neuron. 2017 Jan 4;93(1):99-114. doi: 10.1016/j.neuron.2016.11.035.
Contact: Sandrine Humbert, INSERM, U1216, Univ. Grenoble Alpes, Grenoble Institut des Neurosciences, GIN, Grenoble, France.
Crédit photo : M. Barnat
La Testostérone pour Réparer la Myéline
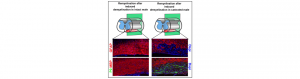
Dans le système nerveux central, les gaines de myéline qui protègent les axones et contribuent à la rapidité de la conduction nerveuse sont produites par les oligodendrocytes. Lors de pathologies démyélinisantes, la myéline détruite peut être spontanément régénérée par un processus appelé remyélinisation. En utilisant un modèle murin de démyélinisation focale de la moelle épinière, une étude récente co-dirigée par le Dr. Michael Schumacher et le Dr. Elisabeth Traiffort (INSERM U1196, Université de Paris-Sud, Université Paris-Saclay) vient de rapporter un rôle clé des gonades mâles, de la testostérone et du récepteur des androgènes dans ce processus régénératif. L’absence de l’hormone sexuelle mâle ou de son récepteur empêche le recrutement des astrocytes au sein de la région démyélinisée et de façon concomitante, prévient la différenciation des progéniteurs oligodendrocytaires en oligodendrocytes matures capables de synthétiser la myéline présente dans le système nerveux central. A la place de cette myéline contenant notamment les deux protéines majeures que sont la protéine basique de la myéline (MBP) et la protéine protéolipidique (PLP), les chercheurs observent la production d’une myéline classiquement synthétisée par les cellules de Schwann dans le système nerveux périphérique et qui est majoritairement composée de la protéine zéro (P0) et de la protéine périphérique de la myéline (PMP22). Ce lien étroit entre la testostérone et la production de myéline pourrait trouver son origine dans l’évolution des espèces animales puisque l’on constate que le récepteur des androgènes est apparu tardivement et en même temps que la myéline chez les vertébrés dotés d’une mâchoire. Ces travaux, publiés récemment dans le journal PNAS, peuvent contribuer à expliquer l’évolution différente des maladies démyélinisantes telles que la sclérose en plaques chez les femmes et chez les hommes et pourraient avoir des implications importantes dans le contexte des désordres psychiatriques ou des pathologies cognitives liées au vieillissement.
Bielecki B, Mattern C, Ghoumari AM, Javaid S, Smietanka K, Abi Ghanem C, Mhaouty-Kodja S, Ghandour MS, Baulieu EE, Franklin RJ, Schumacher M*, Traiffort E*.
(*Co-last authors).
Unexpected central role of the androgen receptor in the spontaneous regeneration of myelin.
Proc Natl Acad Sci U S A click to read. 2016 Dec 20. doi: 10.1073/pnas.1614826113.
Nouvelle méthode de marquage de protéines pour la microscopie super-résolution
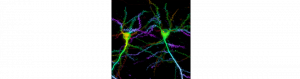
de Olivier Thoumine
Afin de cartographier la dynamique et l’organisation à l’échelle nanométrique des complexes d’adhérence synaptique, nous avons développé une stratégie polyvalente basée sur des monomères de streptavidine (~3 nm) conjugués à des fluorophores organiques robustes. Ces nanosondes ciblent des protéines membranaires sélectivement biotinylées sur une petite étiquette positionnée au niveau de leur domaine extracellulaire. L’approche est très spécifique, et permet un marquage efficace dans des environnements cellulaires confinés avec un encombrement stérique réduit et aucun biais de réticulation par rapport à des sondes multivalentes. Cette stratégie est compatible avec la plupart des techniques de super-résolution (STORM, STED et PAINT), et en mode multi-spectral.
L’article a bénéficié d’un research highlight dans Nature Methods et s’accompagne d’un protocole à paraître prochainement dans Nature Protocols (Chamma et al., sous presse). Nous espérons que cette technique pourra être adoptée par un grand nombre de neuroscientifiques, pour la détection et caractérisation de structures sub-cellulaires neuronales.
CHAMMA I, LETELLIER M, Butler, Tessier B, Lim KH, Gauthereau I, Choquet D, Sibarita JB, Park S, Sainlos M*, THOUMINE O* (*Co-last authors).
Mapping the dynamics and nanoscale organization of synaptic adhesion proteins using monomeric streptavidin.
Nat Comm 2016, Mar 16;7:10773. doi: 10.1038/ncomms10773.
Subventions ERC 2016 pour 4 neurobiologistes français

Quatre neurobiologistes français lauréats des ERC Consolidator Grants :
Karim BENCHENANE, Equipe Memory, Oscillations & Brain States, Brain Plasticity Unit, UMR 8249 CNRS, ESPCI-ParisTech, Paris, pour son projet MNEMOSYNE
« Brain computer interface to study and manipulate memories of aversive experience during sleep »,
Paolo GIACOBINI, Equipe Development & Plasticity of the Neuroendocrine Brain, U1172 INSERM, Lille pour son projet REPRODAM
« Extra-gonadal roles of Anti-Müllerian Hormone in the aetiology of polycystic ovary syndrome: the domino effect to reproductive neuroendocrine dysfunctions »
Fekrije SELIMI, Centre Interdisciplinaire de Recherche en Biologie (CIRB), Collège de France, CNRS UMR 7241 – INSERM U1050 pour son projet SynID
« Activity-dependent modulation of synapse identity »
German SUMBRE, Equipe Développement et Plasticité du Cerveau, IBENS-Ecole Normale Supérieure, CNRS UMR 8197 – INSERM U1024, Paris pour son projet Spontaneous ZeBrain
« Whole-brain dynamics underlying self-generated behaviour »
Des molécules qui ont le rythme

Des corpuscules du noyau de la cellule font rythmer l’expression des gènes sur 24 heures
Pour s’adapter à l’alternance quotidienne de jour et de nuit, tous les organismes ont développé une rythmicité de leurs fonctions sur 24 heures. Au niveau cellulaire, de nombreux gènes suivent une telle rythmicité dont les mécanismes restent méconnus. L’équipe d’Anne-Marie François-Bellan au Centre de recherche en neurobiologie- neurophysiologie de Marseille révèle l’implication dans cette expression rythmique de corpuscules nucléaires dont le nombre varie au cours de 24 heures et le ciblage thérapeutique pourrait permettre de contrôler les pathologies associées à des dysfonctionnements rythmiques. Cette étude est publiée dans la revue eLife.
L’adaptation aux contraintes d’un environnement en évolution permanente impose aux êtres vivants des fluctuations rythmiques de leurs paramètres biologiques. Ces fluctuations concernent une multitude de processus, depuis le métabolisme cellulaire jusqu’aux activités comportementales et physiologiques y compris la température corporelle, la pression sanguine et les taux d’hormones. Les recherches en chronobiologie ont permis de montrer à quel point cette rythmicité, et en particulier sa composante dite « circadienne » pour exprimer le fait qu’elle se manifeste sur une base proche de 24h, est une composante essentielle de cette adaptation des êtres vivants. C’est vraisemblablement parce qu’ils jouent un rôle primordial en tant que mécanismes adaptatifs indispensables à la survie que le dérèglement des rythmes circadiens est associé à de nombreuses pathologies dont les plus étudiées sont les pathologies hormonales et métaboliques, cardiovasculaires, neuropsychiatriques et les cancers slimming tablets.
La rythmicité de bon nombre de fonctions biologiques repose en partie sur la rythmicité d’expression d’ARNm au sein de la cellule. On sait aujourd’hui, contrairement aux idées initiales, que la rythmicité de la majorité des ARNm ne repose pas sur une transcription rythmique. Il est en effet récemment apparu que si jusqu’à 20% des gènes exprimés dans un organe présentent un profil rythmique, seulement 20% des ARNm rythmiques sont contrôlés au niveau transcriptionnel. Un des enjeux actuels en chronobiologie est la recherche de ces mécanismes largement méconnus qui s’exercent après la transcription et sont impliqués dans la régulation des rythmes circadiens.
L’équipe d’Anne-Marie François-Bellan a caractérisé un de ces mécanismes post-transcriptionnels qui permet l’expression rythmique d’ARNm dans des cellules de l’hypophyse. Ce mécanisme implique un long ARN non-codant, Neat1 (Nuclear-Enriched Abundant Transcript 1) dont l’expression rythmique a pu être mise en évidence non seulement dans les cellules hypophysaires mais également dans de nombreux autres oscillateurs circadiens ainsi que dans l’horloge hypothalamique circadienne. Ce long ARN non-codant sert de matrice d’assemblage pour des protéines de liaison aux ARN, l’ensemble formant des corpuscules nucléaires appelés paraspeckles. Les chercheurs ont montré que tous les composants des paraspeckles ainsi que le nombre des paraspeckles, présentent une rythmicité circadienne d’expression et d’association à l’intérieur des cellules hypophysaires.
Bien que leur fonction soit largement méconnue, on sait que ces paraspeckles peuvent entrainer une rétention nucléaire d’ARNm lorsque ceux-ci présentent dans leur région 3’UTR des séquences répétées et inversées de type Alu (IRAlu), ce qui empêche leur export cytoplasmique et permet le contrôle de leur niveau d’expression. Les chercheurs ont alors émis l’hypothèse selon laquelle la rythmicité du nombre de ces corps nucléaires pourrait permettre la rythmicité circadienne des ARNm qu’ils retiennent dans le noyau. De fait, ils ont montré que l’insertion d’une séquence IRAlu dans la région 3’UTR du gène rapporteur egfp, induit une rétention nucléaire rythmique de l’ARNm egfp. Cette rétention est abolie après destruction des paraspeckles par des siRNA ou des oligonucléotides antisens de Neat1. Par vidéo microscopie en temps réel, ils ont montré que cette séquence IRAlu en 3’UTR de l’egfp entraîne une expression cytoplasmique rythmique de la protéine EGFP. Grâce à une technique de précipitation spécifique de l’ARN Neat1, ils ont isolé et, après séquençage haut débit, identifié l’ensemble des ARNm associés à Neat1. A partir d’exemples d’ARNm sélectionnés dans cette liste, ils ont montré que les ARNm associés à Neat1 présentent une rétention nucléaire rythmique abolie après destruction des paraspeckles.
Ces résultats montrent que les paraspeckles, grâce à leur expression circadienne, peuvent contrôler la rythmicité circadienne d’expression des ARNm qui leur sont associés et permettent de proposer un nouveau mécanisme post-transcriptionnel original impliqué dans le fonctionnement du système circadien.
Le ciblage thérapeutique des paraspeckles pourrait être à la base de nouvelles stratégies permettant de contrôler les rythmes circadiens, avec l’objectif d’améliorer les situations, en pathologique humaine, qui sont associées à un dysfonctionnement de la rythmicité des fonctions, en particulier des fonctions hormonales. Outre le décryptage d’un mécanisme post-transcriptionnel impliqué dans la régulation circadienne de l’expression de gènes, une problématique ancrée dans le domaine de la chronobiologie, cette étude, dans le domaine de l’endocrinologie fondamentale et/ou clinique, permet d’attribuer un rôle, dans la physiologie et la pathologie de l’hypophyse, à ce long ARN non-codant, Neat1, dont les fonctions demeurent énigmatiques.
Ce travail a bénéficié d’un prix de recherche Pfizer-Société Française d’Endocrinologie
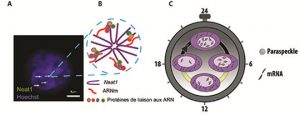
Figure : Structure des paraspeckles et implication fonctionnelle dans l’expression rythmique d’ARNm. A : Visualisation des paraspeckles identifiés par leur constituant principal, le long ARN non-codant, Neat1, à l’intérieur du noyau des cellules coloré en bleu par le colorant de Hoechst. B : Organisation schématique des différents constituants des paraspeckles. C : La rythmicité du nombre de paraspeckles à l’intérieur du noyau permet le contrôle de l’expression des ARNm associés.
© Anne-Marie François-Bellan
En savoir plus
Circadian RNA expression elicited by 3′-UTR IRAlu-paraspeckle associated elements.
Torres M, Becquet D, Blanchard MP, Guillen S, Boyer B, Moreno M, Franc JL, François-Bellan AM.
Elife. 2016 Jul 21;5. pii: e14837. doi: 10.7554/eLife.14837.
Contact chercheur
Anne-Marie François-Bellan
Centre de recherche en neurobiologie – neurophysiologie de Marseille (CRN2M)
CNRS UMR 7286. Université Aix-Marseille
Faculté de Médecine Secteur Nord
51 Boulevard Pierre Dramard
13344 Marseille cedex 15
Tel: 04 91 69 89 07