Un modèle animal inédit pour accélérer la lutte contre la maladie d’Alzheimer ! par Contributeur 30.10.2017 à 09h12
La maladie d’Alzheimer reste aujourd’hui incurable. Parmi les obstacles rencontrés pour développer des traitements efficaces figure l’impossibilité de « cibler » la maladie avant un stade avancé. Or, les caractéristiques biologiques de la maladie d’Alzheimer apparaissent au moins vingt ans avant la manifestation des symptômes cliniques (perte de mémoire, troubles émotionnels, etc.). Il faudra donc comprendre cette phase silencieuse (ou infra-clinique) pour espérer pouvoir soigner les patients alors que les atteintes cérébrales sont encore réversibles. Jusqu’à présent, il n’existait pas de modèles in vitro ou animaux qui permettent d’étudier cette longue période précédant l’apparition de symptômes cognitifs. La collaboration entre des équipes de chercheurs du département MIRCen du CEA, de l’Inserm, des universités Paris-Sud et Paris-Descartes et du CNRS a abouti au développement d’une technologie disruptive qui permet d’induire chez des rats adultes une « maladie d’Alzheimer » présentant les deux types de lésions et mimant de manière fidèle la progression de celle-ci dès ses premières phases de développement.
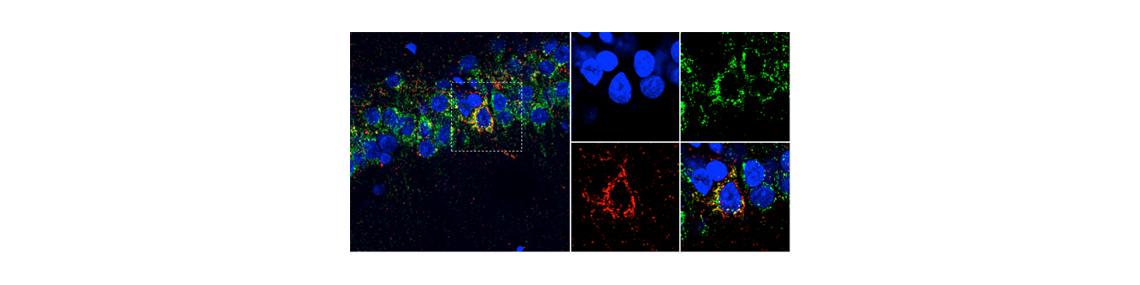
Dans l’article publié dans le journal Cerebral Cortex, le modèle, baptisé AgenT, est induit chez le rat à l’âge adulte par co-transfert stable des gènes humains mutés APP et PS1 à l’aide de Virus Adéno-Associés (AAV) dans l’hippocampe des animaux. Cette approche a permis la production localisée des protéines APP et PS1 dans un nombre très réduit de neurones. Ces neurones vont produire des peptides Aß42 qui vont alors diffuser dans l’ensemble du tissu hippocampique. La grande majorité du tissu hippocampique ne présente ainsi pas de modification génétique, ce qui en fait un modèle pertinent pour les formes non génétiques de la maladie qui représentent plus de 95% des cas. Sa pertinence physiopathologique a été validée en le comparant à des échantillons post-mortem de patients. La concentration des peptides Aß42 va progressivement augmenter pour atteindre en fin de vie de l’animal des concentrations comparables à celles mesurées dans l’hippocampe des patients. Une hyper-phosphorylation de la protéine Tau endogène va alors graduellement se mettre en place, simultanément les capacités de mémoire vont progressivement décliner, reproduisant la cinétique de progression de la pathologie humaine. Les plaques amyloïdes et l’angiopathie amyloïde cérébrale ne se développent qu’en fin de vie de l’animal. Des agrégats intra-neuronaux de protéine Tau hyper-phosphorylée confirment un engagement complet de la pathologie Tau.
Le fait de disposer de rongeurs modélisant de manière pertinente les stades cliniquement silencieux de la maladie va ainsi permettre 1/ d’étudier la phase précoce de la maladie, phase où le développement de celle-ci semble encore réversible, 2/ d’évaluer l’efficacité des candidats médicaments en caractérisant leurs effets sur les deux voies pathologiques (amyloïde et/ou Tau) et 3/ de définir des marqueurs sanguins spécifiques des stades précoces de la maladie, qui pourraient permettre un diagnostic dès 50 ans chez l’Homme.
Références :
Audrain M1,2,3, Souchet B1,3,4, Alves S1,3, Fol R1,2,3, Viode A5, Haddjeri A6, Tada S1,3, Orefice NS1,3, Joséphine C3,7, Bemelmans AP3,7, Delzescaux T3,7, Déglon N8,9, Hantraye P3,7,10, Akwa Y11, Becher F5, Billard JM6, Potier B6, Dutar P6, Cartier N1,3, Braudeau J1,3.
βAPP Processing Drives Gradual Tau Pathology in an Age-Dependent Amyloid Rat Model of Alzheimer’s Disease.
Cerebral Cortex. 2017. DOI 10.1093/cercor/bhx260
1 INSERM UMR1169, Université Paris-Sud, Université Paris-Saclay, Orsay 94100, France.
2 Université Paris Descartes, Paris, France.
3 CEA, DRF, Institut Francois Jacob, MIRCen, Fontenay-aux-Roses 92265, France.
4 Université Paris Saclay, Paris, France.
5 CEA, Institut Frédéric Joliot, Service de Pharmacologie et d’Immunoanalyse, 91191, Gif-sur-Yvette, France.
6 INSERM UMR894, Centre de Psychiatrie et Neurosciences, Université Paris Descartes, Sorbonne Paris Cité, Paris, France.
7 CNRS UMR9199, Fontenay-aux-Roses 92265, Université Paris-Sud, Université Paris-Saclay, Orsay 94100, France.
8 Department of Clinical Neurosciences, Laboratory of Cellular and Molecular Neurotherapies, Lausanne University Hospital, Lausanne, Switzerland.
9 Neuroscience Research Center, Laboratory of Cellular and Molecular Neurotherapies, Lausanne University Hospital, Lausanne, Switzerland.
10 INSERM UMS27, Fontenay-aux-Roses 92265, Université Paris-Sud, Université Paris-Saclay, Orsay 94100, France.
11 INSERM U1195 and Université Paris Sud and Université Paris-Saclay, 80 rue du général Leclerc, 94276 Le Kremlin-Bicêtre, France.
Communiqué de presse :
Contact :
Jérôme Braudeau, Ph.D.
AgenT, CEA Fontenay aux Roses, Bât 61, Bureau 125, 18 route du panorama, 92260 Fontenay-Aux-Roses, France