Catégorie : Divers

Faits marquants 2016
Une sélectionné de quelques publications en neurosciences parmi les plus remarquables publiées en 2016. Consultez les faits marquants 2016 >>

La huntingtine, une protéine essentielle à l’assemblage du cortex cérébral
Le cortex des mammifères est formé de six couches de neurones dont l’assemblage est précisément régulé au cours du développement.…
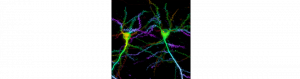
Nouvelle méthode de marquage de protéines pour la microscopie super-résolution
de Olivier Thoumine Afin de cartographier la dynamique et l’organisation à l’échelle nanométrique des complexes d’adhérence synaptique, nous avons…

Subventions ERC 2016 pour 4 neurobiologistes français
Quatre neurobiologistes français lauréats des ERC Consolidator Grants : Karim BENCHENANE, Equipe Memory, Oscillations & Brain States, Brain Plasticity Unit,…

Des molécules qui ont le rythme
Equipe AM François Bellan Des corpuscules du noyau de la cellule font rythmer l’expression des gènes sur 24 heures …

Les mitochondries sont essentielles à la mémoire
De nombreuses études ont montré que la prise de cannabis peut entraîner des pertes de mémoire à court et à…

Tau et déficits cognitifs : les lymphocytes T en action !
La maladie d’Alzheimer (MA) est la plus fréquente des démences. Elle touche environ 900.000 personnes en France et plus de…
Rencontre « French Neuroscience Showcase: Academia meets Industry »
En marge du congrès SfN à San Diego, Aviesan, le Consulat Général de France à Los Angeles et la Chambre…

Syndrome autistique : un nouveau gène responsable identifié
La délétion du gène TSHZ3 responsable d’un syndrome autistique Un consortium international, réunissant chercheurs et cliniciens autour des équipes de…
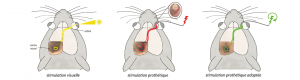
Rétines artificielles : de sérieuses pistes pour une vision plus nette
Formidable défi thérapeutique, les prothèses rétiniennes, développées depuis une dizaine d’années, permettent à certaines personnes aveugles de percevoir des signaux…
