Divers
Retour sur les Journées thématiques de la Société des Neurosciences

Escale au bord de la Loire…
Les 24 et 25 mai derniers, plus de 200 participants ont assisté aux 2e Journées Thématiques de la Société des Neurosciences organisées à Tours par la Structure Fédérative de Recherches de Neuroimagerie Fonctionnelle de Tours-Poitiers. Ces journées se sont déroulées dans la salle Thélème de l’université François-Rabelais de Tours et étaient consacrées à « La plasticité cérébrale, de la recherche fondamentale à la clinique ». Vingt conférences, dont la prestigieuse Lecture Alfred Fessard donnée par Geneviève Rougon, ont été présentées et suivies par des chercheurs et des cliniciens, majoritairement issus des laboratoires français mais aussi par quelques collègues étrangers. Les discussions et les échanges ont été nombreux lors des pauses café et buffets et autour des quarante-sept posters principalement présentés par des étudiants. Dix d’entre eux ont été sélectionnés pour une présentation de leurs travaux sous la forme de communication-flash de 5 minutes.
Ces journées se sont terminées par une conférence à l’attention du public tourangeau au cours de laquelle Hervé Platel (Inserm Caen) a abordé la question : Arts, cerveau et vieillissement – de la musique pour bien vieillir ? De nombreux échanges ont eu lieu à l’issue de cette conférence, à laquelle ont participé environ 130 personnes.
Les organisateurs remercient chaleureusement la Société des Neurosciences pour leur avoir confié l’organisation de ces journées, et les nombreux sponsors pour leur indispensable soutien.
Les lauréats du prix de thèse de la Société des Neurosciences

Les trois lauréats du prix de thèse de la Société des Neurosciences ont reçu leur prix lors des 2e Journées Thématique organisées à Tours les 24 et 25 mai dernier. Ils ont brièvement résumé leurs travaux de thèse.
Mon projet de thèse a porté sur l’étude de la fonction de la protéine LGI1, dont le dysfonctionnement est responsable d’une épilepsie héréditaire du lobe temporal et d’épilepsies auto-immunes. Mes travaux de recherche ont consisté à déterminer la période développementale et les populations de neurones qui contribuent à la pathologie à l’aide de lignées de souris génétiquement modifiées. Mes résultats ont permis de démontrer que les neurones excitateurs jouaient un rôle majeur dans cette épilepsie, et que LGI1 était indispensable au maintien d’une excitabilité neuronale normale tout au long de la vie. De plus, j’ai montré que LGI1 est un acteur essentiel de l’élément présynaptique et que son absence entraîne une libération excessive de glutamate aux synapses excitatrices qui pourrait être à l’origine des crises d’épilepsie. La meilleure compréhension de la fonction de LGI1 devrait maintenant permettre d’identifier de nouvelles cibles thérapeutiques dans l’épilepsie.
Le cervelet joue un rôle déterminant dans l’apprentissage, le maintien de la posture et la coordination motrice. Au sein du réseau neuronal cérébelleux, les informations sensorielles convergent vers la cellule de Purkinje qui possède un rôle clé dans le traitement des informations. Il est donc important de comprendre comment la connectivité de celle-ci est modifiée durant un apprentissage moteur. Ma thèse a consisté à étudier les voies de signalisation moléculaire impliquées suite à l’activation de récepteurs pré- et/ou post-synaptiques durant des protocoles de plasticité synaptique à la synapse entre fibres parallèles et cellules de Purkinje. Ces résultats expérimentaux nous ont permis la confection d’un modèle mathématique qui prédit le signe de la plasticité synaptique à partir de patrons d’entrées arbitraires sur la cellule de Purkinje. L’ensemble de ces études permettra de mieux comprendre le mécanisme de stockage de l’information dans le cortex cérébelleux, et potentiellement d’identifier des cibles pharmacologiques permettant de résoudre ou de corriger des désordres cérébelleux.
De nombreuses études ont mis en évidence un rôle du sommeil dans la consolidation de la mémoire. Cette consolidation durant le sommeil serait permise par des répétitions des informations vécues lors de l’éveil. Il a été montré chez le rongeur que des cellules de lieu, qui s’activent de façon spécifique selon notre localisation dans l’espace, étaient réactivées durant le sommeil, comme si l’animal rejouait les trajectoires qu’il avait faites durant l’éveil. Nous avons utilisé ces réactivations des cellules de lieu afin de créer un souvenir artificiel entre un lieu et une récompense durant le sommeil, au moyen d’une interface cerveau-machine. La création de ce nouveau souvenir a permis de démontrer le rôle causal de ces neurones dans la navigation spatiale.
Un résumé des découvertes 2015 de la Neuroendocrinologie Française
La Neuroendocrinologie est une discipline transversale par excellence qui étudie les interactions réciproques entre le système nerveux et les systèmes endocrines et neuroendocrines. C’est une discipline centrale en neurosciences qui aborde des sujets de santé publique majeurs et d’agronomie. La Société de Neuroendocrinologie fédère une quarantaine de laboratoires et environ 250 chercheurs et étudiants français et francophones qui se réunissent chaque année dans un colloque ouvert aux autres sociétés internationales de neuroendocrinologie.
En décembre 2015, le conseil scientifique de la Société de Neuroendocrinologie a sélectionné quelques articles de très haut niveau scientifique publiés en 2015 par des membres de notre communauté afin de faire connaître sous forme de plaquette des avancées scientifiques majeures.
Contrôle de la fertilité : des microARNs responsables !
Des ARN particuliers de petites tailles sont responsables du contrôle de l’expression de la gonadolibérine ou GnRH (Gonadotropin Leasing Hormone), une neurohormone qui pilote la maturation sexuelle, l’apparition de la puberté et la fertilité à l’âge adulte. C’est ce que vient de démontrer l’équipe « Développement et plasticité du cerveau neuroendocrine » dirigée par Vincent Prévot, Directeur de recherche Inserm (Centre Jean-Pierre Aubert, Lille). L’intervention des micro-ARNs, transcrits de l’ADN, s’opère autour de la naissance, et marque une étape clé du développement postnatal. Une défaillance de l’action de ces micro-ARNs entraine une perturbation, voire l’arrêt total, de la production de GnRH par les neurones de l’hypothalamus qui la synthétise, et ainsi une infertilité. Dans les cas les plus graves, une stérilité peut intervenir. Le détail de ces travaux sur la souris est publié dans la revue Nature Neuroscience datée du 2 mai 2016.
Pour en savoir plus, lire le communiqué de presse Inserm.
“A microRNA switch regulates the rise in hypothalamic GnRH production before puberty”
Andrea Messina1,2,7, Fanny Langlet1,2,3,9, Konstantina Chachlaki1,2,9, Juan Roa4,5,9, S Rasika6, Nathalie Jouy1,2, Sarah Gallet1,2, Francisco Gaytan4,5, Jyoti Parkash1,2,8, Manuel Tena-Sempere4,5, Paolo Giacobini1,2, Vincent Prevot1,2
1 Inserm, Laboratory of Development and Plasticity of the Neuroendocrine Brain, Jean-Pierre
Aubert Research Centre, U1172, F-59000 Lille, France
2 University of Lille, FHU 1000 days for Health, School of Medicine, Lille, F-59000, France
3 Columbia University Medical Center and Berrie Diabetes Center, New York, NY 10032,USA
4 Department of Cell Biology, Physiology and Immunology, University of Cordoba & Instituto Maimonides de Investigación Biomédica de Cordoba (IMIBIC/HURS), 14004 Cordoba,Spain
5 CIBER Fisiopatología de la Obesidad y Nutrición, Instituto de Salud Carlos III, 14004 Cordoba, Spain
6 Inserm UMR1141 – PROTECT (Promoting Research Oriented Towards Early CNS Therapies), 75019, Paris, France
7 Present address: University of Lausanne, CHUV, Lausanne, Switzerland
8 Present address: Centre for Animal Sciences, Central University Punjab, 151001 Bathinda, India
9 These authors contributed equally to this work
Nature Neuroscience, 2 mai 2016, doi:10.1038/nn.4298
Contact chercheur
Vincent Prévot
Directeur de recherche Inserm
Equipe « Développement et plasticité du cerveau endocrine »
Centre Jean-Pierre Aubert, Unité Inserm 1172, Lille
Tel: 03 20 62 20 64
Courriel
Des oscillations 4-Hz impliquées dans le comportement de peur
Par Cyril Herry
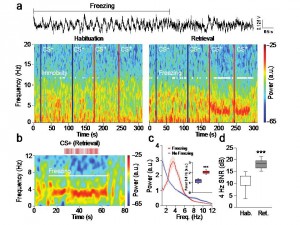
Les réponses adaptatives de peur face à des situations traumatisantes ou menaçantes nous aide à échapper à un danger potentiel. Ces réponses de peur peuvent être apprises par le biais d’une association entre un stimulus neutre au départ et la présence d’un facteur stressant (par exemple un danger physique). Cette association très robuste permet la formation d’une trace de mémoire qui persiste pendant des années et génère des modifications structurelles et fonctionnelles dans le cerveau. Cet apprentissage associatif peut se réaliser en une seule fois et chaque exposition ultérieure au stimulus conditionné induit une récupération de la mémoire associative. La mémoire de peur se manifeste au travers d’une large gamme de réponses physiologiques telles qu’une augmentation de la transpiration, des tremblements, ainsi qu’une augmentation du rythme cardiaque. D’un point de vue neuronal, les corrélats physiologiques de ces réponses de peur sont encore largement inconnus.
Au laboratoire, la mémoire de peur est modélisée par la mise en œuvre d’un conditionnement de type Pavlovien au cours duquel un stimulus tel qu’un son est répétitivement associé à un évènement aversif léger comme un choc électrique délivré aux pattes de l’animal. La peur conditionnée de l’animal se manifeste notamment par une réponse conditionnée d’immobilisation appelée freezing. Des décennies de recherche dans le domaine ont permis d’identifier de multiples régions cérébrales impliquées dans le conditionnement auditif de peur, en particulier, le cortex préfrontal médian dorsal (CPFmd) et l’amygdale basolatérale (BLA) qui sont des structures clefs pour l’acquisition et l’expression des réponses conditionnées de peur. Bien que le freezing soit une mesure classique de la peur largement utilisée, les mécanismes neuronaux permettant l’expression de cette réponse comportementale sont encore largement inconnus.
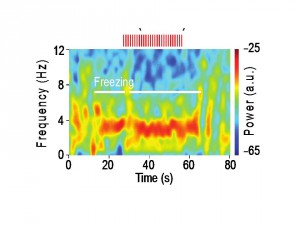
Afin de répondre à cette question, nous nous sommes focalisés dans cette étude sur les processus neurobiologiques associés à cet état comportemental de peur par la mise en oeuvre d’approches comportementales, électrophysiologiques et optogénétiques. Dans cette étude nous mettons en évidence pour la première fois que le comportement de freezing est associé à un état cérébral généré de façon interne qui se manifeste par la mise en œuvre d’oscillations soutenues autour de 4 Hz au niveau du CPFmd et du BLA. De façon intéressante, nous avons observé que cet état oscillatoire prédit le début et la fin des épisodes de freezing et permettait le couplage d’activité neuronale entre le CPFmd et le BLA. Grâce à des analyses causales, nous avons identifié que l’activation des neurones du CPFmd précédait l’activation des neurones de l’amygdale pour chaque cycle de 4 Hz ce qui suggère un rôle clef de ces oscillations préfrontales dans le contrôle de l’expression des réponses conditionnées de peur. Finalement, grâce à la mise en œuvre de manipulation optogénétiques innovantes, nous avons démontré que l’induction artificielle d’oscillations 4 Hz dans le CPFmd était une condition suffisante pour l’induction du comportement de freezing et la synchronisation d’activité neuronale entre le CPFdm et le BLA.
Dans leur ensemble, ces résultats identifient une signature physiologique de la mémoire de peur au sein des circuits préfrontaux-amygdaliens et suggèrent que l’altération des oscillations 4 Hz dans ce circuit pourrait représenter une stratégie thérapeutique potentielle pour les pathologies anxieuses.
Source: “4-Hz oscillations synchronize prefrontal–amygdala circuits during fear behavior”
Karalis N, Dejean C, Chaudun F, Khoder S, Rozeske R, Wurtz H, Bagur S, Benchenane K, Sirota A, Courtin J, Herry C
Nature Neuroscience, 2016 doi:10.1038/nn.4251
Copyright © 2016, Rights Managed by Nature Publishing Group
Oscillations 4 Hz dans le cortex préfrontal au cours du comportement de freezing.
a, Haut, Exemple représentatif d’oscillation 4 Hz dans le cortex préfrontal au cours du freezing. Bas, Spectrograms représentatifs des potentiels de champs préfrontaux avant et après conditionnement lors de la présentation du son contrôle (CS-) ou du son conditionné (CS+).
b, Spectrogram représentatif des potentiels de champs préfrontaux à une résolution temporelle plus fine lors de la présentation du son contrôle conditionné (CS+) associé à un comportement de freezing.
c-d, Analyse spectrale moyennée mettant en évidence une augmentation des oscillations préfrontales 4 Hz pendant les périodes de freezing et au cours de la récupération des réponses de peur après conditionnement.
Power & Care, Bruxelles, 9-11 septembre 2016
— Evènement non scientifique —
Mind & Life Europe est une organisation à but non lucratif entre neuroscience et méditation qui a pour but de promouvoir la science contemplative en Europe.
Mind & Life Europe est le pendant européen du Mind & Life Institute fondé par feu le neuroscientifique Francisco Varela, et par le Dalai Lama et Adam Engle.
Mind & Life Europe organise du 9 au 11 septembre 2016 à Bruxelles,« Power & Care », un dialogue Mind & Life avec Sa Sainteté le Dalaï Lama.
Cet évènement explorera de quelle manière les deux forces primaires du pouvoir et de la considération pour autrui, ou « care », peuvent être fructueusement alliées et ainsi engendrer des actions pour promouvoir la prospérité des êtres vivants et de notre environnement.
Le programme comprend les points de vue des sciences naturelles, des neurosciences, de l’anthropologie, de la psychologie, de la politique, de l’économie, et des traditions contemplatives du monde.
Une sélection d’ateliers permettra aux participants de travailler sur les dynamiques du pouvoir et de la considération pour autrui à l’intérieur d’eux-mêmes. Une représentation et un concert seront proposés le premier soir.
Les intervenants compteront Matthieu Ricard, Ph.D.; Prof. Dr Tania Singer; Jane Goodall, Ph.D., DBE.; Prof. Sir Paul Collier; Dr Vandana Shiva; et Prof. Frans B. M. de Waal, Ph.D., parmi d’autres.
La langue de travail de Power & Care sera l’anglais.
Billets / Infos
Mind & Life Europe organise également « Engagement individuel et responsabilité collective », une conférence publique avec S.S le Dalaï Lama, l’après-midi du Dimanche 11 septembre 2016, à Bruxelles. Cette conférence publique sera en anglais, avec traduction en français et en néerlandais.
Pour plus d’infos
Channelopathy meeting Paris, June 15-17 Abstract submission extended
Abstract submission deadline is extended to April 6, 2016
If your research or clinical activity drives you into the field of CHANNELOPATHIES, don’t miss the unique international event « Channelopathy 2016 » that will take place in Paris (June 15-17, 2016): . World-renowned speakers, pioneers in the field of channelopathies, will present their latest discoveries (check the online program: Program)!
Because the meeting is limited to 180 attendees, registrations will be taken on a first-come first-served basis. So we strongly recommend to register as early as possible! (Online registration: Registration) Registration fees include the get-together party on Wednesday evening, as well as Thursday and Friday breaks and lunches.
Submit your abstract before April 6, 2016: The organizing committee will choose oral presentations from the abstracts in any of the seven sessions. There will be prizes for junior scientists presenting posters and oral presentations. Ask your students and fellows to submit their abstracts now! Submit online: Abstract.
The organizing committee is looking forward to meeting you in Paris for three days of exceptional ion channel science!
Key dates at-a-glance:
Abstract submission deadline: April 6, 2016
Early-bird registration deadline: April 30, 2016
Late registration deadline: June 13, 2016
Meeting: June 15-17, 2016
L’huntingtine : ses liens avec la Maladie de Huntington et ses fonctions cellulaires normales…
La revue écrite par Sandrine Humbert et Frédérique Saudou dans la revue Neuron présente de manière remarquable les principales découvertes de ces dernières années sur l’huntingtine. Ces deux chercheurs INSERM de l’Institut des Neurosciences de Grenoble, pionniers dans la découverte du rôle central de l’huntingtine dans le transport axonal, le contrôle du métabolisme énergétique et la division cellulaire, soulignent combien cette protéine au-delà de son rôle toxique dans la maladie de Huntington est, par sa biologie complexe, au cœur de nombreuses fonctions du système nerveux. Cette somme impressionnante de connaissances laisse entrevoir l’espoir de mieux comprendre la Maladie de Huntington et par la même identifier à terme une stratégie thérapeutique efficace.
La maladie de Huntington est une maladie neurodégénérative héréditaire dominante touchant des individus jeunes (35 ans en moyenne). La maladie de Huntington est une maladie « rare » (prévalence ~1/10000), mais elle représente en France plus de 6000 patients. Elle est caractérisée par trois types de symptômes : des mouvements involontaires (chorée), des déficits cognitifs, et des atteintes psychiatriques associée à une atrophie cérébrale qui touche de manière précoce le striatum. Le décès des patients survient quinze à vingt ans après que les premiers symptômes soient détectés. Bien qu’un grand nombre de laboratoires et équipes cliniques en France et dans le monde entier, soutenus par les associations de malades et leurs familles, concentrent leurs efforts de recherche sur la maladie de Huntington, il n’existe à l’heure actuelle aucune thérapie pouvant ralentir l’aggravation inexorable de la maladie.
Les principales caractéristiques héréditaires et neurologiques de la maladie ont été décrites par une jeune médecin, le Dr George Huntington en 1872. C’est plus d’un siècle plus tard, en 1993, que l’anomalie génétique responsable de la maladie de Huntington a été identifiée. Il s’agit d’une expansion anormale de triplet CAG dans la partie codante du gène de la protéine huntingtine. Comment cette mutation pourrait conduire à la dégénérescence des neurones ? Quelles sont les fonctions biologiques de la protéine huntingtine normale ? Quels mécanismes pourraient expliquer que la mutation qui produit une expansion anormale d’un segment polyglutamine dans l’huntingtine, fragilise préférentiellement les neurones du système nerveux ? Les chercheurs neurobiologistes et cliniciens ont abordé ces questions cruciales depuis plus de vingt ans. Sandrine Humbert et Frédéric Saudou nous rappellent les principales découvertes liées à ces questions.
L’huntingtine peut être considérée comme une protéine d’échafaudage. Elle est exprimée dans tous les types cellulaires. Plusieurs de ses domaines fonctionnels sont retrouvés dans des organismes très anciens au plan phylogénétique. L’huntingtine possède un nombre impressionnant de partenaires protéiques qui agissent dans des fonctions cellulaires diverses. Depuis plus de 15 ans, plusieurs travaux ont montré son rôle anti-apoptotique, en agissant à divers niveaux de la cellule. Les découvertes récentes sur l’huntingtine normale (sauvage) et la forme mutée ont mis en évidence son implication dans la régulation de la transcription, des moteurs moléculaires du transport axonal, des générateurs locaux d’énergie pour le transport des vésicules, de l’endocytose, de l’orientation du faisceau mitotique et de l’autophagie.
Par ses fonctions variées, l’huntingtine interviendrait ainsi dans divers processus neurobiologiques du cerveau adulte mais également pendant le développement et si son rôle dans la maladie de Huntington est certain, elle pourrait également intervenir indirectement dans d’autres pathologies psychiatriques et neurologiques.
S’il n’existe pas encore de traitement pour bloquer ou retarder l’évolution de la maladie de Huntington, la somme impressionnante des connaissances accumulées depuis la découverte du gène, permet de mieux appréhender la complexité de la biologie de l’huntingtine. Améliorer notre compréhension de cette biologie est un axe de recherche crucial pour à terme découvrir une thérapie efficace pour la maladie de Huntington.
Référence de l’article : Saudou F, Humbert S. The Biology of Huntingtin. Neuron. 2016, 89:910-26. doi: 10.1016/j.neuron.2016.02.003.
Lien vers l’article : Neuron
Contacts: Frédéric Saudou & Sandrine Humbert – University Grenoble Alpes, Grenoble Institut des Neurosciences, GIN, 38000 Grenoble, France; INSERM, U1216, 38000 Grenoble, France; CHU Grenoble Alpes, 38000 Grenoble, France.
Suivre des récepteurs membranaires à l’échelle de la molécule unique et en temps réel: enfin possible dans le cerveau !
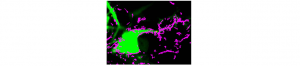
La communication entre les cellules du cerveau repose grandement sur l’activation de récepteurs aux neurotransmetteurs. Cette voie de communication est essentielle pour la transmission basale et la plasticité des synapses, et son dysfonctionnement serait à la base de maladies neuropsychiatriques, comme la schizophrénie. Comprendre la régulation de ces récepteurs est donc un enjeu majeur en neuroscience fondamentale et clinique. Grâce à un travail interdisciplinaire, une barrière méthodologique vient d’être franchie. En effet, Juan Varela et ses collaborateurs ont réussi à suivre, en temps réel et l’échelle de la molécule unique, des récepteurs aux neurotransmetteurs dans le tissu cérébral intact. Ce travail, publié dans le revue Nature Communications, a permis de démontrer que la dynamique des récepteurs dans un tissu natif est très semblable à celle observée dans des préparations in vitro. La grande dynamique membranaire des récepteurs aux neurotransmetteurs est donc, plus que jamais, un mécanisme central de la communication cérébrale. Les perspectives sont multiples tant pour la compréhension « nanoscopique » de la transmission synaptique in vivo mais aussi de ses dysfonctionnements dans des grandes pathologies neurologiques et psychiatriques.
Contact : Laurent Groc, Directeur Recherche CNRS, Directeur Equipe, IINS – CNRS – Universite de Bordeaux
Cours FreeSurfer
Cours consacré au logiciel FreeSurfer
Co-organisé par le Martinos Center et l’Unité Imagerie et Cerveau INSERM U930 – Université François-Rabelais de Tours
26-27 mai 2016 Tours
Ce cours est co-organisé par l’Unité Imagerie et Cerveau Inserm U930 et le Martinos Center for Biomedical Imaging de Charlestown, MA (USA) qui développe ce logiciel.
La formation, limitée à 64 personnes, couvrira l’analyse surfacique de données individuelles et en groupe ainsi que l’utilisation de FreeSurfer pour l’analyse de données tractographiques.
Elle se déroulera à l’Ecole Polytechnique de l’Université de Tours et fera suite aux 2e Journées Thématiques de la Société des Neurosciences, organisées à Tours les 24 et 25 mai.
Un site web fournit toutes les informations nécessaires aux personnes intéressées.
Les inscriptions sont dés à présent ouverte sur le site.