Intestin et cerveau dans la maladie de Parkinson : une voie à double sens par Contributeur 29.05.2020 à 03h51
Plusieurs études ont récemment montré que la maladie de Parkinson pourrait trouver son origine dans l’intestin. En effet, des agrégats de la protéine alpha-synucléine, jouant un rôle clé dans le développement de la maladie, sont présents dans l’intestin. Une étude récente menée par une équipe franco-espagnole, chez des primates non-humains, montre que, non seulement la pathologie liée à l’alpha-synucléine peut être transportée de l’intestin vers le cerveau, mais aussi du cerveau à l’intestin. Cette étude ouvre de nouvelles perspectives sur notre compréhension du rôle de l’axe intestin/cerveau dans l’initiation et la propagation de la pathologie de la maladie de Parkinson.
La maladie de Parkinson est caractérisée, d’une part par la mort cellulaire d’une population neuronale spécifique, et d’autre part, par l’accumulation de la protéine alpha-synucléine dans ces cellules. L’idée que l’axe intestin-cerveau pourrait jouer un rôle dans l’initiation de la maladie a vu le jour en 2003 lorsqu’une équipe de neuro-anatomistes a découvert la présence d’inclusions d’alpha-synucléine dans le système nerveux entérique (i.e. intestin) de personnes décédées de la maladie de Parkinson. Cette découverte a permis de développer l’hypothèse selon laquelle la pathologie liée à l’accumulation d’alpha-synucléine se propagerait de l’intestin au cerveau. Cependant, l’origine intestinale de la MP n’a pas été prouvée chez les primates non humains et la possibilité que l’alpha-synucléine soit également transportée du cerveau à l’intestin est toujours à l’étude.
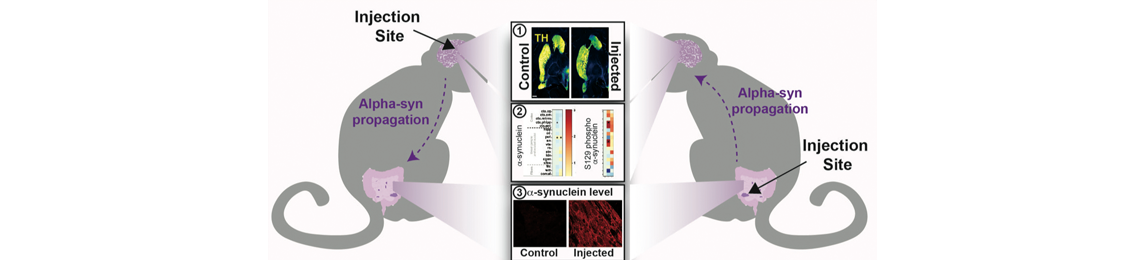
Des données récentes montrent que l’injection dans le cerveau d’agrégats d’alpha-synucléine provenant de cerveaux parkinsoniens peuvent initier et propager le processus neurodégénératif qui caractérise la maladie de Parkinson, chez la souris et le primate. L’étude entreprise ici chez les primates non-humains montre que l’injection d’agrégats d’alpha-synucléine provenant de cerveaux parkinsoniens, induit :
1- une neurodégénérescence, deux ans après l’injection, indépendant du site d’injection, cerveau ou bien intestin ;
2- des dépôts de la forme pathologique de la protéine alpha-synucléine, à la fois dans le système entérique et dans le cerveau. Il existe une corrélation entre le niveau élevé d’alpha-synucléine dans les neurones entériques et la neurodégénérescence progressive de la voie nigrostriatale ;
3- une accumulation d’une forme pathologique de l’alpha-synucléine, à la fois dans le cerveau et dans le système entérique, suite à une injection intracérébrale.
Ces résultats indiquent que la propagation de l’alpha-synucléine peut avoir lieu non seulement de l’intestin vers le cerveau, mais également du cerveau vers l’intestin. Comprendre comment la maladie se développe au fil du temps pourrait ouvrir la porte au développement de nouvelles approches thérapeutiques. Bien que d’autres expériences soient nécessaires, l’étude suggère également que la transmission de la pathologie de la α-synucléine ne passerait pas par le nerf vague comme cela avait été suggéré précédemment mais via un mécanisme systémique possible, dans lequel la circulation générale agirait comme une voie de transmission bidirectionnelle à longue distance de la α-synucléine endogène, renforçant le rôle prédictif de l’alpha-synucléine en tant que biomarqueur.
There is growing evidence that Parkinson’s disease (PD) may begin in the gut, with aggregates of the protein alpha-synuclein arising in the gut, playing a key role in the development of the disease. In experiments in non-human primates, a team of Spanish and French researchers say they have found additional evidence that brain alpha-synuclein can also travels down to the gut. This study offers a new invaluable primate data exploring the role of the gut-brain axis in the initiation and propagation of PD pathology.
Parkinson’s disease is characterized by the cell death of a specific neuronal population and by the buildup of a misfolded protein, called alpha-synuclein, in the cells of the brain. The research about the gut-brain axis emerged in 2003 when a neuroanatomists team spotted alpha-synuclein inclusions within the enteric nervous system of people who had died with PD. They proposed a staging scheme in which α-synuclein pathology spread from the gut to the brain. However, the intestinal origin of PD has not been proved in nonhuman primates and the bidirectional travel of alpha-synuclein is still under investigation. Recent data show that extracted α-synuclein aggregates of brains of dead patients have the ability to initiate and extend the neurodegenerative process that typifies Parkinson’s disease in mice and primates.
The study conducted in non-human primates shows that injection of extracted α-synuclein aggregates from PD patients have the ability to induce:
1- Two years after administration, injected monkeys displayed neurodegeneration regardless of the injection site, in the brain or in the gut.
2- Alpha-synuclein deposits of the pathological form of the protein was observed both in the enteric system and in the brain. We can observe a high α-synuclein level in enteric neurons correlated with the progressive destruction of the nigrostriatal pathway.
3- When the aggregates were injected into the brain, pathologic form of alpha-synuclein was observed both in the brain and in the enteric system and vice-versa.
These results indicate that both brain and gut injections of aggregates can induce α-synuclein pathology in the enteric system, demonstrating the bidirectional long-distance propagation of α-synuclein pathology between the brain and the gut in the non-human primate. Although further experiments are necessary, the study also suggests that the transmission of α-synuclein pathology does not go through the vagus nerve as it was previously suggested, but through a possible systemic mechanism, in which the general circulation would act as a route for long-distance bidirectional transmission of endogenous α-synuclein” explained Dr. Dehay, strengthening the predictive role of alpha-synuclein as a biomarker.
Pour en savoir plus:
Bidirectional gut-to-brain and brain-to-gut propagation of synucleinopathy in non-human primates. Arotcarena ML, Dovero S, Prigent A, Bourdenx M, Camus S, Porras G, Thiolat ML, Tasselli M, Aubert P, Kruse N, Mollenhauer B, Trigo-Damas I, Estrada C, Garcia-Carrillo N, Vaikath NN, El-Agnaf OMA, Herrero MT, Vila M, Obeso JA, Derkinderen P, Dehay B, Bezard E. Brain. 2020 May 1;143(5):1462-1475.
Contact chercheurs:
Benjamin Dehay, Ph.D
Erwan Bézard, Ph.D
Institut des Maladies Neurodégénératives (IMN), CNRS UMR 5293, Université de Bordeaux
Figure : Les injections cérébrales et intestinales d’une fraction enrichie d’agrégats humains d’alpha-synucléine induisent : 1 une dégénérescence nigro-striatale, 2 une pathologie alpha-synucléine dans le système nerveux central et 3 une pathologie alpha-synucléine dans le système entérique.
© Celine Perier