Catégorie : Divers
Channelopathy meeting Paris, June 15-17 Abstract submission extended
Abstract submission deadline is extended to April 6, 2016 If your research or clinical activity drives you into the field…
L’huntingtine : ses liens avec la Maladie de Huntington et ses fonctions cellulaires normales…
La revue écrite par Sandrine Humbert et Frédérique Saudou dans la revue Neuron présente de manière remarquable les principales découvertes…
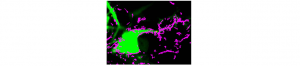
Suivre des récepteurs membranaires à l’échelle de la molécule unique et en temps réel: enfin possible dans le cerveau !
Suivre des récepteurs membranaires à l'échelle de la molécule unique et en temps réel : enfin possible dans le cerveau…
Cours FreeSurfer
Cours consacré au logiciel FreeSurfer Co-organisé par le Martinos Center et l’Unité Imagerie et Cerveau INSERM U930 – Université François-Rabelais…
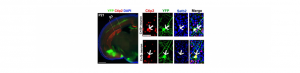
La différenciation des neurones pyramidaux du cortex cérébral est sous l’influence de modifications épigénétiques postnatales
Le cortex cérébral traite l’information sensorielle de notre environnement en activant les réseaux de neurones excitateurs et inhibiteurs interconnectés les…
Etude des réseaux neuronaux impliqués dans le comportement de fuite chez le poisson zèbre
Quels processus neuronaux sont en jeu lorsqu’un organisme détecte un danger avant de s’enfuir ? L’équipe de Filippo Del Bene (Equipe…
6th annual Art of Neuroscience competition
The 6th annual Art of Neuroscience competition is now open for submissions. This is an international competition open to scientists…
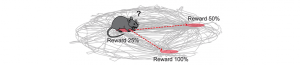
Acétylcholine et prise de décision
La curiosité n’est pas un « vilain » défaut chez les souris ! Quand un évènement inattendu surgit, il faut…
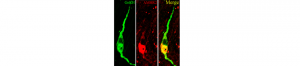
Infertilité : un mécanisme cérébral totalement inédit
Le plus fréquent des troubles de la fertilité féminine – le syndrome des ovaires polykystiques (SOPK) – impliquerait la surexcitation…

Schizophrénie: une nouvelle piste dans la compréhension des déficits de mémoire sociale
La schizophrénie est une maladie psychiatrique qui se manifeste très souvent à l’âge adulte. Les symptômes les plus fréquents comprennent…
